서 론
캐슬만병(Castleman’s disease)은 드문 양성 림프증식성 질환으로 여포성 림프절의 과형성을 특징으로 한다[1]. 해부학적 분포에 따라 단발성과 다발성으로 나뉘며, 단발성일 경우 보통 서서히 크기가 증가하면서 양성의 임상경과를 보이지만, 다발성의 경우 급속도로 진행하여 수주 안에 사망에 이르게 하는 나쁜 예후를 보이는 경우도 있어서 빠른 진단 및 치료가 필요하다[2]. 캐슬만병의 원인과 병리에 대해서는 명확히 밝혀지지 않은 부분이 많았으나 최근 발생 원인으로 바이러스와의 연관성이 점차 밝혀졌으며, 특히 인간 면역결핍바이러스(human immunodeficiency virus, HIV)와의 관련성이 있는 것으로 알려져 있다[3]. 그러나 대부분 다발성 캐슬만병은 HIV 음성이며, 이 경우는 human herpesvirus-8 (HHV-8) 양성인 경우와 음성인 경우로 분류된다. HHV-8 양성인 경우는 음성인 경우보다 훨씬 드물고, HHV-8 양성 여부에 따라 치료가 달라지기 때문에 조직이나 혈장에서 polymerase chain reaction로 이를 확인하는 것이 중요하다.
단발성 캐슬만병은 단일병변에 대하여 수술적 절제가 가장 중요한 치료이다. 다발성 캐슬만병의 경우 이전에는 림프종의 치료와 유사하게 다양한 복합 항암치료를 시행하였으나[4], 최근에는 비교적 표준치료가 잘 정립되어서 HHV-8 음성인 경우 실툭시맙(siltuximab), 양성인 경우에는 리툭시맙(rituximab) 기반의 치료법을 선택하게 된다[5,6]. 다발성 캐슬만병은 드문 질환으로 아직까지 국내의 전향적 연구는 없으며, 몇몇 단일기관의 후향적 연구가 있다[4,7]. Min 등[8]이 캐슬만병 88명을 후향적으로 분석한 연구에 의하면, 전체 환자 중 HHV-8 양성 환자는 단 두 명에 불과하다. 2018년부터 국내에서 HHV-8 음성 환자에서 실툭시맙 치료의 보험급여가 적용됨에 따라 다발성 캐슬만병의 치료성적이 좋아졌으며, 이 환자들에 대한 치료 및 예후를 분석하는 후향적 연구가 발표되고 있다[8]. 하지만 그 연구들에서도 HHV-8 양성 다발성 캐슬만병 환자들은 매우 소수여서 이들의 치료결과에 대한 국내 연구는 부족한 실정이다.
이에 본 저자들은 HHV-8 양성 다발성 캐슬만병 환자에서 리툭시맙 단독 치료에 좋은 치료반응을 보였던 사례를 경험하였기에 이 증례를 보고하는 바이다. 본 증례보고는 순천향대학교병원 연구윤리심의위원회 심의 후 승인을 받았다.
증 례
81세 여자 환자가 한 달 전부터 발생한 호흡곤란과 기침, 발열, 야간발한, 전신 부종을 호소하여 순천향대학교 의과대학 서울병원에 내원하였다. 환자는 흡연이나 음주를 하지 않았으며, 거주지는 서울이었고, 폐질환을 일으킬 수 있는 직업력이 없었다. 그리고 신체 계측에서 신장은 152 cm, 체중은 49.5 kg, 체질량지수(body mass index)는 18.83 kg/m2였다.
내원 시 진찰소견에서 혈압 122/56 mm Hg, 맥박 86/회, 호흡 18/회, 체온 38.2°C, 산소포화도는 96%였으며, 의식은 정상이었다. 만성 병색소견을 보이고 있었으며, 결막이 창백하였고 양측 하지의 함요부종이 있었다. 왼쪽 목부위에서 다발성의 유동적인 종물이 촉지되었다.
검사실 소견으로는 혈액학적 검사에서 백혈구 5,200/μL(정상범위, 4,000–10,000/μL), 혈색소 7.0 g/dL(정상범위, 12–16 g/dL), 혈소판 73,000/μL(정상범위, 130,000–450,000/μL)을 보였다. 생화학적 검사에서 요소질소(blood urea nitrogen) 20.3 mg/dL(정상범위, 6–20 mg/dL), 크레아티닌(creatinine) 0.60 mg/dL(정상범위, 0.5–1.2 mg/dL), aspartate aminotransferase 33 U/L(정상범위, 0–40 U/L), alanine aminotransferase 20 U/L(정상범위, 0–41 U/L), 젖산탈수소효소(lactate dehydrogenase) 207 U/L(정상범위, 0–250 U/L)으로 정상범위였다. 알부민 2.7 g/dL(정상범위, 3.5–5.2 g/dL), 글로불린 4.7 g/dL(정상범위, 1.2–2.5 g/dL)로 알부민이 감소되어 있는 소견을 보였다. 직접 항글로불린검사(Coombs direct antiglobulin test)에서 3+로 양성반응을 보였고, C-반응성 단백, HIV검사는 음성이었다.
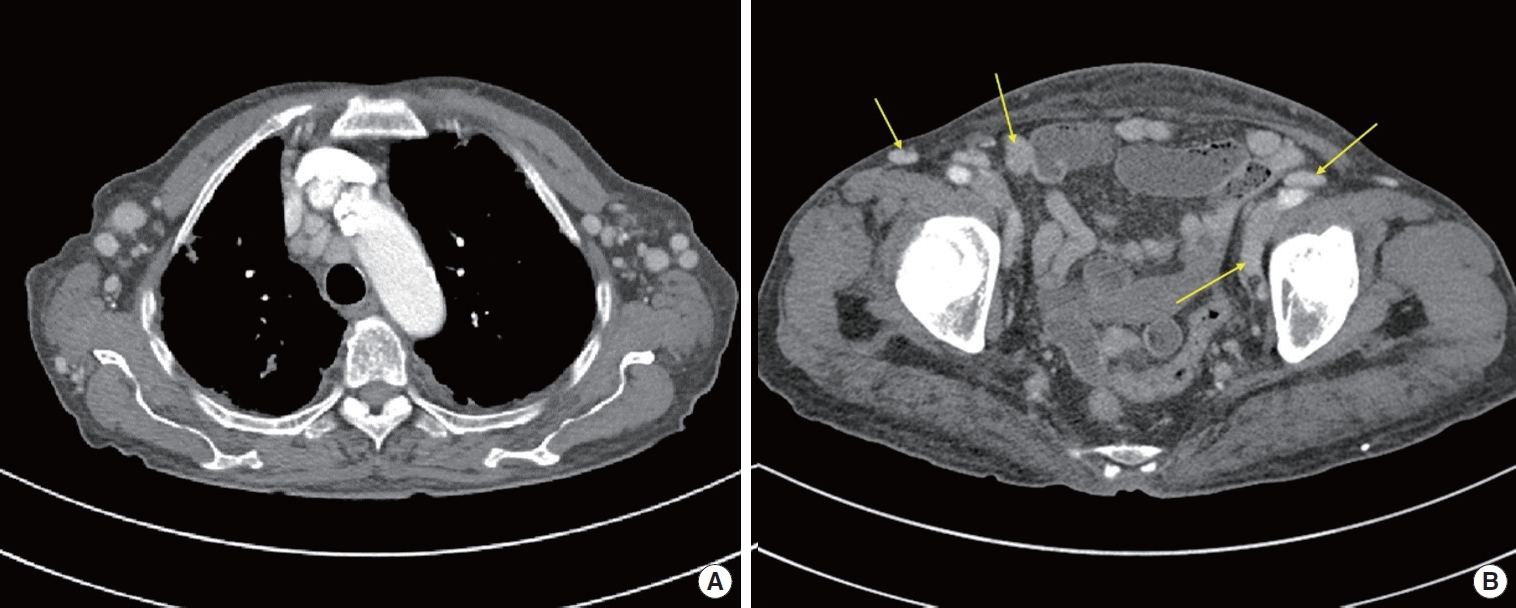
영상검사로는 경부, 흉부 및 복부 컴퓨터 단층촬영을 시행하였고, 그 결과 경부, 액와부 및 서혜부를 포함한 전신의 다발성 림프절 종대 소견이 확인되었다(Fig. 1).
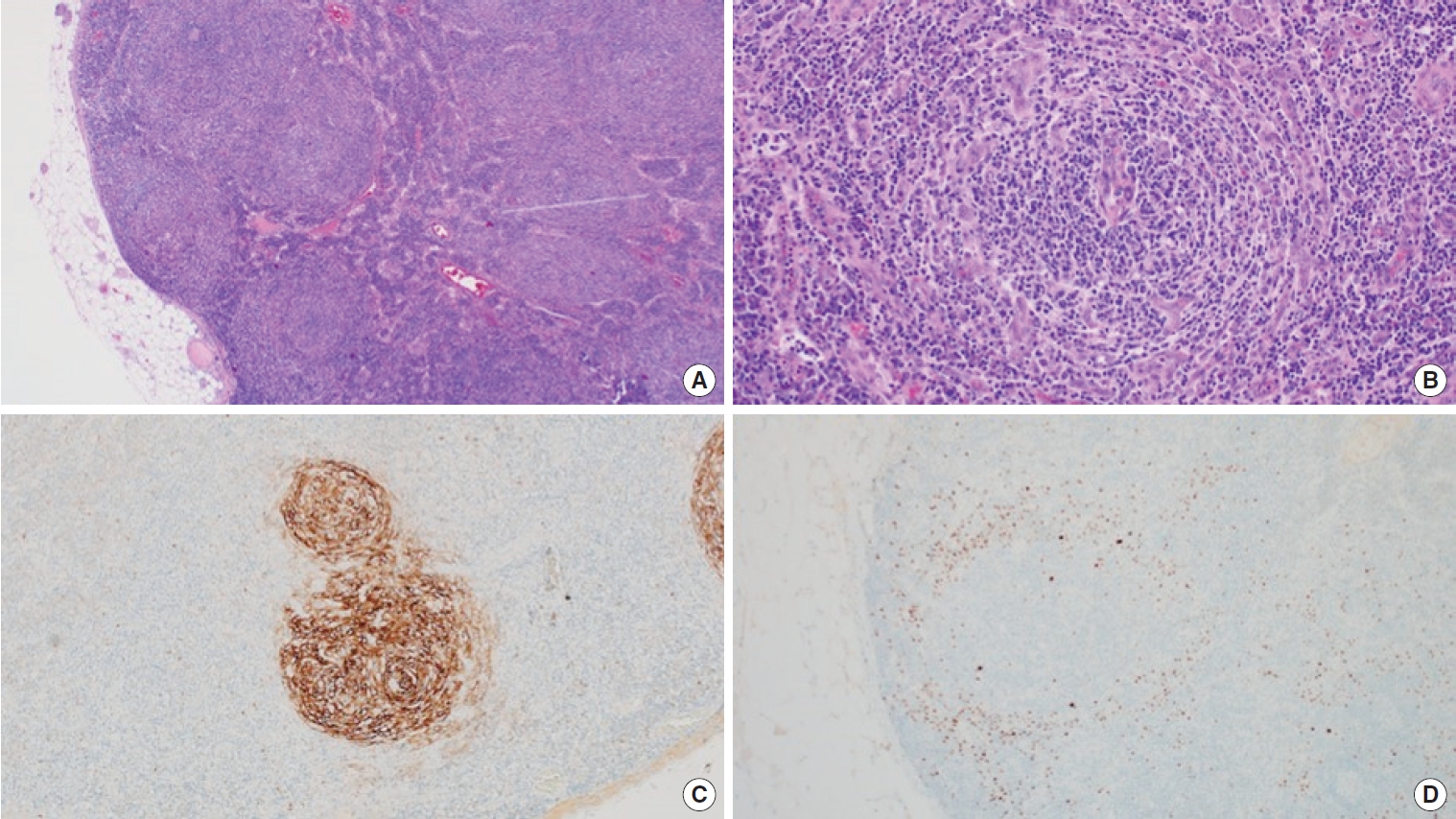
컴퓨터 단층촬영을 통해 악성질환을 감별하기 위해 조직검사 및 양전자 방출 컴퓨터단층촬영(positron emission tomography– computed tomography, PET–CT)을 시행하였다. 가장 크기가 큰 좌측 쇄골 위 림프절을 절개 및 조직검사를 시행하였고, 조직검사에서 얻어진 검체는 조직병리학적 검사에서는 저배율 현미경 소견상 폐쇄된 림프소절이 다수 관찰되며 림프소절 사이지역(interfollicular zone)이 확장되고 세포의 증식이 일어났으며 다수의 형질세포가 관찰되었다. 여포 내부로 관통해 들어가는 세정맥(venule)이 관찰되었고 맨틀구역(mantle zone)이 합쳐지고 1개 이상의 종자 중심(germinal center)을 포함하는 소견이 관찰되었다. 면역조직화학염색 소견상 HHV-8 양성 세포가 다수 관찰되어 HHV-8과 연관된 다발성 캐슬만병에 합당한 소견으로 최종 진단되었으며(Fig. 2), 폐렴이 동반되어 있는 상태였다.
환자는 발열, 부종, 기침, 자가면역성 용혈성 빈혈소견이 있어 활동성 질환에 해당되었으며, 장기부전이 없었고, HIV 음성, HHV-8 양성이었으므로 NCCN (National Comprehensive Cancer Network) 가이드라인에 따라 리툭시맙 단독요법으로 1주일 간격으로 4회 투여하였다. 또한 동반된 폐렴에 대해서는 항생제 레보플록사신을 함께 투여하였다.
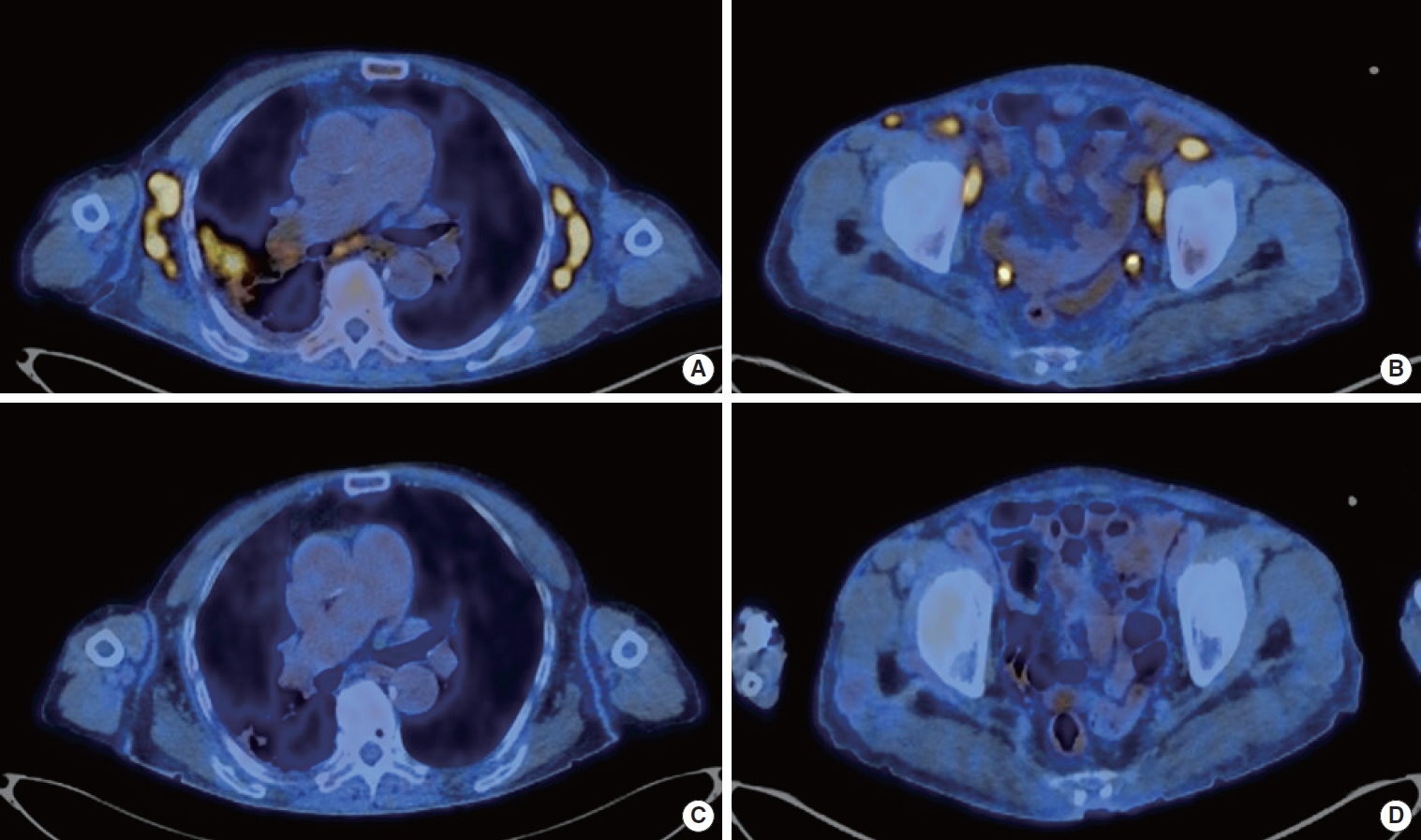
리툭시맙 투여를 시작하고 나서 전신상태, 호흡곤란, 기침 및 발열이 모두 호전되었다. 리툭시맙 마지막 투여 후 1개월째에 PET–CT 및 흉부, 복부 컴퓨터단층촬영을 시행하였으며, 이전 영상검사에서 보였던 림프절종대가 사라져 완전반응(complete response)을 보였다(Fig. 3). 또한 혈액검사에서 혈색소 14.1 g/dL, 혈소판 269,000/μL로 빈혈과 혈소판 감소증도 호전되었다. 현재 7개월째 완전반응이 유지되고 있다.
고 찰
본 증례는 국내에서 매우 드물게 보고되고 있는 HHV-8 양성 다발성 캐슬만병이며, 병리조직검사를 통해 진단된 이후 리툭시맙 단독으로 치료를 진행하여 완전반응에 이르는 좋은 치료반응을 보였던 사례였다.
캐슬만병은 흔하지 않은 림프증식성 질환이며, 림프구의 증식으로 인한 사이토카인 분비가 증가되어 발열, 기침, 발한, 부종과 같이 비특이적인 증상이 나타나는 병이다. 영상검사를 통해 림프절종대를 확인해야 하며, 진단을 위해 조직검사를 시행했을 때, 조직병리학적으로 (1) 단발성의 림프절종대와 함께 하이알린 혈관성(hyaline-vascular) 패턴을 보이거나, (2) 혈관이 과증식(hypervascular) 되어 있거나, (3) 형질세포의 비율이 높은 특징을 보인다. 또한 HIV, HHV-8의 감염 여부를 확인하는 것이 치료의 방향을 결정하는 데 필수적인 요소이다[3].
본 증례의 경우에도 처음 증상이 발생하여 응급실에 내원하였을 때는 폐렴을 의심하여 폐렴에 대한 치료를 진행하였으나 빈혈 및 혈소판감소증과 함께 임상증상이 호전되지 않아 추가검사를 진행하여 확진을 하였다.
일반적으로 단발성 캐슬만병은 수술이나 방사선치료가 가능하기에 예후가 좋지만, 다발성의 캐슬만병은 그보다 예후가 좋지 않은 것으로 알려져 있다[4].
HHV-8 양성인 경우는 HHV-8에 감염된 림프구의 증식에 의한 interleukin 6 (IL-6) 유사체의 분비에 의해 증상이 발생한다고 알려져 있으며, HHV-8 음성인 경우에는 원인이 정확하게 알려져 있지않고 자가면역반응, 자가염증반응, 신생물 생성, 원인 미상의 감염에 의하여 발생할 수 있다고 추정하고 있다[9].
HHV-8 양성인 다발성 캐슬만병의 경우 중앙생존기간이 26개월에서 30개월 사이로 예후가 불량하다고 알려져 있으나[10], 리툭시맙 기반의 치료를 시행하여 치료성적이 매우 향상되었으며, 5년 생존율이 92%까지 증가되었다[2,11]. 리툭시맙은 면역글로불린 G1의 단클론성 항체로, 대다수의 B세포의 표면에 존재하는 단백질인 CD20을 표적으로 하여 CD20 양성의 B세포를 고갈시켜 면역반응을 억제하여 골수증식성 질환을 치료하는 약제이다. HHV-8 양성 다발성 캐슬만병에서는 HHV-8에 감염된 림프구의 증식이 일어나며 HHV-8에서 기인한 IL-6의 유사체의 분비에 의해 캐슬만병의 병태생리가 일어난다고 알려져 있어, 이에 HHV-8에 감염된 림프구에 존재하는 CD20을 표적으로 림프구 증식을 억제하는 리툭시맙을 투여하여 치료한다[12]. 하지만 아직까지 HHV-8 양성 다발성 캐슬만병에 있어서 리툭시맙 단독치료는 국내에서 보험급여 적용이 되지 않아서 환자가 본인부담으로 고가의 약제 비용을 감당해야 하는 문제점이 있다. HHV-8 양성 다발성 캐슬만병 환자가 리툭시맙 단독치료에 반응하지 않았을 경우에 에토포사이드(etoposide), 독소루비신(doxorubicin)을 병용투여하며 재치료 또는 자가 조혈모세포 이식까지 고려할 수 있으나, 대다수의 환자는 리툭시맙 단독치료만으로 좋은 효과를 보이는 것으로 알려져 있다[13].
최근에는 다발성 캐슬만병에 대하여 항IL-6 단클론성 항체인 실툭시맙이 새로운 치료제로 제시되었으며, 림프구 증식으로 인해 따른 IL-6의 분비가 늘어나는 것을 억제하여 치료하는 기전을 가지고 있다. 국내에서는 2018년부터 HHV-8 음성 다발성 캐슬만병에서 실툭시맙 투여가 건강보험 급여 적용이 되었으며, 이를 토대로 좋은 치료 성적을 보이고 있음을 몇몇 후향적 연구에서 확인할 수 있다. 드문 질환인 다발성 캐슬만병 중 더욱 드문 HHV-8 양성 다발성 캐슬만병에서도 표준치료인 리툭시맙 단독치료가 급여가 되어 치료접근성이 강화될 필요가 있을 것으로 보인다.
본 증례의 경우는 HHV-8 양성 다발성 캐슬만병을 림프절조직 검사를 통해 진단 후, 리툭시맙을 투여하여 치료를 하였고 단기간에 빠른 반응을 보이며 완전관해까지 획득한 드문 증례로 보고하는 바이다.