ABSTRACTObjective:Lamivudine (LAM) is the first nucleoside analog approved for chronic hepatitis B (CHB) patients, but acquired mutation of the reverse transcriptase of the virus during long-term therapy is limiting its use. Adeforvir dipivoxil (ADV) add-on therapy with ongoing LAM use has been a standard therapy for LAM resistance. The aim of this study was to explore the predictive factors associated with delayed virologic response at 12 months in patients who could not achieved initial virologic response (IVR) of add-on therapy.
Methods:One hundred and ninety three LAM-resistant CHB patients who had been on ADV add-on therapy with LAM and were not achieved IVR at 6 months were enrolled. They were classified into delayed viral response (DVR) group and non-DVR group, according to delayed viral response (VR) at 12 months of add-on therapy. Clinical factors predicting delayed VR at 12 months of add-on therapy were evaluated.
Results:DVR rate was 20.7% (n= 40) at 12 months after the add-on treatment. Female (adjusted odds ratio, 3.463; P= 0.002), lower hepatitis B virus (HBV) DNA at baseline (< 7.0 log copies/mL/ ≥ 7.0 log copies/mL; adjusted odds ratio, 0.369; P= 0.012), and negative HBeAg at baseline (adjusted odds ratio, 0.332; P= 0.034) were significant independent factors predicting DVR after 12 months of treatment.
서 론경구용 뉴클레오시드 유사체인 라미부딘(lamivudine)은 만성 B형 간염 환자에서 승인된 첫 번째 뉴클레오시드 유사체로서 효과적인 치료제로 사용되어 왔으나, 장기간 투여 시 hepatitis B virus(HBV) DNA 중합효소에 돌연변이가 출현하여 약제 감수성 감소에 의한 바이러스 돌파현상 및 임상소견 악화를 초래하는 문제가 있다[1]. 아데포비어 디피복실(adefovir dipivoxil, 아데포비어)은 뉴클레오티드 유사체로 라미부딘 내성을 획득한 만성 B형 간염 환자에서 아데포비어 단독치료(monotherapy) 또는 병합치료(add-on therapy)를 통해 구원치료제로서 자리매김해왔다. 라미부딘 내성 환자에서 아데포비어 단독으로 전환 후의 장기간 치료성적을 연구한 이전의 문헌을 살펴보면, 5년 누적 바이러스 반응(cumulative virologic response)은 48.8%였고, 5년 누적 유전자 내성 및 바이러스 돌파가 각각 65.6%, 61.8%로 나타나 아데포비어 단독치료는 라미부딘 내성에 대한 첫째 대안이 될 수 없음을 지적하였다[2]. 또한 엔테카비어(entecavir) 단독치료군 또는 아데포비어 단독치료군에 비해 라미부딘에 아데포비어를 병합한치료군(add-on therapy)에서 HBV의 증식을 보다 효과적으로 억제하여 바이러스 돌파 및 유전자 내성의 발생이 적음을 입증하는 연구결과들이 발표됨에 따라[3-8], 현재 가이드라인에서도 라미부딘 내성에 대한 구원치료의 방법으로 라미부딘에 아데포비어를 병합하여 사용하는 것을 권고하고 있다[9].
이러한 아데포비어 병합요법에서도 바이러스 내성이 발생하고, 충분한 바이러스 반응을 보이지 않는 경우가 있어, 아데포비어 병합요법의 바이러스 반응에 영향을 미치는 인자에 대한 연구들이 진행되었다. 낮은 HBV DNA와 높은 기저 alanine aminotransferase(ALT)를 보일 경우 바이러스 반응이 좋다고 예측되었고[4], 병합치료 6개월째의 조기치료 반응(initial virologic response)이 좋을수록 장기적인 치료 반응도 우수함이 증명되어 조기치료 반응에 따라 타약제로의 변경을 고려할 수 있는 근거가 되었다[10-12].
그러나 비록 6개월째 조기치료 반응을 획득하지 못하더라도 치료를 유지한 군에서 좀 더 지연되어 12개월째 바이러스 반응을 획득하는 경우가 있고, 이를 예측할 수 있는 인자에 관한 연구는 많지 않다. 본 연구자들은 라미부딘 사용 중 내성이 발생하여 아데포비어를 병합 투여한 환자군 중 6개월째 HBV DNA의 음전이 없는 환자에서 12개월째 HBV DNA 음전을 예측할 수 있는 인자들을 분석하여 아데포비어 병합요법 시에 지연 바이러스 반응을 기대할 수 있는 요인에 대하여 평가하고자 한다.
대상 및 방법1. 연구방법본 연구는 후향적 코호트 연구로서 2007년 1월부터 2011년 6월까지 순천향대학교 부천, 서울, 천안병원에서 만성 B형 간염 환자 중 라미부딘을 투여받은 총 1,538명 중 라미부딘 내성이 발생하여 아데포비어를 병합투여하여 6개월째 초기 바이러스 반응(initial virologic response)이 없는 환자 193명을 의무기록을 통해 선별하였다. 만성 C형 간염, human immunodeficiency virus 양성, 알코 올성간질환, 약제유발성간질환, 자가면역간염이 있거나, 1년 이내에 추적 소실된 환자들은 연구대상에서 제외하였다. 환자들에게 처방된 라미부딘 용량은 하루 100 mg 1회였으며, 아데포비어는 하루 10 mg 1회 투여하였다. 초기 바이러스 반응은 6개월 병합치료 후 HBV DNA 음전 여부로 정의하였고, 지연된 바이러스 반응(delayed virologic response) 12개월까지 병합치료 후 HBV DNA 음전 여부로 정의하였다. HBV DNA는 real time polymerase chain reaction(PCR)을 통해 copies/mL의 단위로 보고하였으며, log HBV DNA copies/mL로 변환하여 자료를 분석하였고, 검출 한계 미만일 때를 음전으로 정의하였다. 라미부딘 내성의 확인은 환자의 혈청에서 분리된 HBV DNA를 PCR 후 역전사효소 부위에 대해 염기서열분석을 통해 역전사효소 204에서 ATT, GTG type 및 역전사 효소 180에서 ATG type의 돌연변이를 검출하여 M204V, M204I, M204V+L180M, M204I+L180M, M204V/I+L180M으로 분류하였다. 간경변증 환자에서 간의 대상성 유지 정도에 따라 세부 그룹으로 분류하기 위해 Child-Turcotte-Pugh score (CTP score)를 사용하였다.
초기 6개월 바이러스 반응이 없는 환자 193명을 대상으로 12개월까지 병합치료를 유지하였을 때 12개월 바이러스 반응을 획득한 군과 획득하지 못한 군으로 나누어 지연된 12개월 바이러스 반응에 영향을 미치는 인자를 조사하였다. 본 연구는 순천향대학교 임상연구심의위원회에서 승인되었다.
결 과1. 전체 환자군의 기본적인 특성전체 193명의 환자군의 기본적인 특성은 Table 1에 표시되어 있다. 평균 연령은 44.6세(±11.5)였고, 남성 139명(72%)과 여성 54명(28%)으로 구성되었다. 간경변증 환자는 66명(34.2%)이었고, CTP score에 따라서 분류하였을 때, 5점 44명(66.7%), 6점 10명(15.2%), 7점 8명(12.1%), 8점 3명(4.5%), 9점 1명(1.5%)의 순서로 대상성이 유지된 환자들이 대부분을 차지하였다. 라미부딘 단독치료기간의 평균은 27.3 (±17.1)개월이었다. 라미부딘과 아데포비어 병합치료 시작 시점의 기저 HBV DNA는 평균 7.1 (±1.3) log copies/mL이었다. 병합치료 시작 시점에는 HBeAg 양성 환자는 169명(87.6%)이었고, 병합치료 6개월 후 HBeAg 양성 환자는 159명(82.4%)이었다. 병합 치료 시작 시점의 aspartate aminotransferase (AST)와 ALT의 평균치는 각각 104.5 (±149.4) IU/L, 150.4 (±244.1) IU/L이었다.
2. 지연된 치료 반응에 따른 환자군의 차이아데포비어 병합치료 6개월째에 초기 바이러스 반응을 획득하지 못한 193명에 대해 12개월째에 지연된 바이러스 반응을 보였던 군과 지연된 바이러스 반응을 보이지 못했던 군으로 분류하였다(Fig. 1). 병합치료의 초기 바이러스 반응이 없는 환자 총 193명에서 12개월째 바이러스 반응을 획득한 환자는 40명(20.7%)이었고, 12개월째에도 바이러스 반응을 보이지 않은 환자는 153명(79.3%)이었다. 12개월째 바이러스 반응을 획득한 환자들에서 통계학적으로 유의하게 여성의 비율이 더 많았고(47.5 vs. 22.9%, P= 0.002), 라미부딘 단독치료기간이 더 길었으며(32.0 vs. 26.0개월, P= 0.050), 병합치료 시작 시점의 HBV DNA가 더 낮았고(6.4 vs 7.4 log copies/mL, P= 0.000), 병합치료 시작 시점에 HBeAg 양성인 환자가 더 적었다(75.0 vs. 90.8%, P= 0.013). 또한 12개월째 바이러스 반응을 획득한 환자들에서 병합치료 시작 시점의 AST (149.1 vs. 92.8 IU/mL, P= 0.147) 및 ALT (227.3 vs. 130.3 IU/mL, P= 0.147)가 더 높았으나 통계학적인 유의성은 없었다. 그 밖에 두 군 사이에 나이, 간경변증 동반 여부, 대상성 유무(CTP score 및 class), 라미부딘 내성 돌연변이의 종류 등은 통계학적으로 의미 있는 차이를 보이지 않았다.
3. 지연된 치료 반응을 예측할 수 있는 인자아데포비어 병합치료 6개월째에 바이러스 초기 반응을 획득하지 못하였으나 12개월째에 지연된 바이러스 반응을 예측할 수 있는 인자를 단순로지스틱회귀분석 및 다중로지스틱회귀분석을 이용하여 분석하여 교차비(odds ratio, OR) 및 95% 신뢰구간(confidence interval, CI)을 P값과 함께 표시하였다(Table 2). 단순로지스틱회귀분석에서 여성일수록(male/female: OR, 3.050; 95% CI, 1.476 to 6.306; P= 0.003), 병합치료 시작 시점의 HBV DNA가 7 log copies/mL 미만으로 낮을수록(<7.0/≥7.0 log copies/mL: OR, 0.291; 95% CI, 0.141 to 0.601; P= 0.001), 병합치료 시작 시점의 HBeAg가 음성일 경우(HBeAg negative/positive: OR, 0.302; 95% CI, 0.123 to 0.745; P= 0.009), 병합치료 6개월째 HBeAg가 음성일 경우(HBeAg negative/positive: OR, 0.330; 95% CI, 0.148 to 0.740; P= 0.007) 12개월 병합 치료하였을 때 HBV DNA 음전을 예측할 수 있었다. 단순로지스틱회귀분석에서 의미 있는 예측인자로 나온 변수들로 다중로지스틱회귀분석을 시행하여 보정된 교차비(adjusted OR) 및 통계학적 유의성을 확인하였다. 여성일수록(male/female: adjusted OR, 3.463; 95% CI, 1.579 to 7.595; P= 0.002), 병합치료 시작 시점의 HBV DNA level이 7 log copies/mL 미만으로 낮을수록 (<7.0/≥7.0 log copies/mL: adjusted OR, 0.369; 95% CI, 0.170 to 0.802; P= 0.012), 병합치료 시작 시점의 HBeAg가 음성일 경우 (HBeAg negative/positive: adjusted OR, 0.332; 95% CI, 0.120 to 0.919; P= 0.034) 12개월 병합치료 시에 HBV DNA 음전을 예측할 수 있었다.
4. 지연 반응을 보인 환자군의 추적관찰지연 반응을 보인 40명 중에서 12명의 환자를 2013년 4월 시점까지 추적관찰이 가능하였다. 그 중 10명의 환자들은 병합치료를 유지하였으며, 간세포암종의 발생으로 간이식을 시행 받은 1명과 간세포암종의 발생으로 사망한 1명을 제외하면, 최종적으로 8명(66.7%)의 환자에서 평균 43.5개월의 관찰기간 동안 라미부딘과 아데포비어의 병합치료를 유지하면서 바이러스 돌파현상 없이 안정적인 상태를 유지하고 있다. 추적관찰기간 중 나머지 2명은 아데포비어 단독치료로 전환하였다. 지연 반응을 보인 환자군에서 추후 아데포비어 내성 발생 여부를 확인하기 위해 아데포비어 내성검사를 시행했는지 검토하였으나, 해당 검사를 시행한 예를 확인할 수 없었다.
고 찰HBV 감염으로 인한 만성간질환 및 이로 인한 사망은 전 세계적으로 그리고 HBV 감염이 만연한 한국에서도 매우 중요한 보건문제의 하나로, 항바이러스 치료는 HBV 관련 만성간질환의 진행을 늦추어 간경변증 및 간세포암종으로의 진행 및 관련된 사망을 줄이는 데 기여하고 있다.
라미부딘은 FDA에서 첫 번째로 승인된 뉴클레오시드 유사체로, 현재까지도 이미 과거에 처방한 환자들에게서 상당수 처방을 유지하고 있으며, 다른 약제에 비해 비용이 덜 들고 안정성이 확립되어있다는 장점이 있다[9]. 그러나 라미부딘은 장기간의 치료 시에 역전사효소 부위 M204V/I 및 L180M 돌연변이의 발생으로 내성이 잘 일어나 내성률은 1년 사용 시 14-32%, 5년 사용 시 60-70%로 보고되며[13,14], 이런 제한점 때문에 치료에 대한 반응이 좋으리라고 기대되거나 단기간의 치료가 계획된 경우를 제외하고는 현재 라미부딘은 초치료약제로 선호되지 않는다[9].
라미부딘 내성에 대한 대책으로 아데포비어 또는 다른 뉴클레오티드 유사체로 전환 또는 병용하는 방법이 사용되어 왔다[9]. 아데포비어는 초치료 환자에서 라미부딘에 비해 내성 발현이 적으나, 다른 경구용 항바이러스제에 비하여 항바이러스 효과가 약하고 1년 이상 사용 시 내성 발생이 증가하는 경향이 있어, 타약제 내성 바이러스에 대한 구원치료제로서 다른 약제와의 병합치료에 주로 사용되는 약물이다[9]. 라미부딘으로 치료하던 만성 B형 간염 환자에서 라미부딘 내성 발생 시에 아데포비어로 전환하는 것보다, 라미부딘에 아데포비어를 병합하여 투여하였을 때 3년간 바이러스 내성이 거의 나타나지 않는 것으로 보고되어[15], 본 연구의 대상 환자를 수집하던 시기에는 만성 B형 간염 환자에서 라미부딘 사용시 내성이 발생하였을 때 라미부딘을 투여하면서 아데포비어를 병합하여 투여하는 방법이 가장 효과적인 치료로 받아들여졌었다[9]. 이후 발표된 라미부딘과 아데포비어 병합요법의 장기치료성적을 연구한 문헌에서도 4년 후 바이러스 반응(HBV-DNA 3 log copies/mL 미만)이 90.8%로 매우 효과적인 치료임은 분명하다[16]. 본 연구는 기본적으로 12개월째의 지연 반응을 조사한 연구로, 지연반응을 획득한 40명의 환자들에서 추적관찰이 가능하였던 12명에서 평균 43.5개월의 관찰기간 동안 66.7%의 환자에서 장기적인 바이러스 반응(바이러스 검출 한계 미만)을 확인하였지만, 이는 앞의 연구와 비교하기에는 바이러스 반응의 시간 및 양적 기준 설정이 다르며, 통계학적 의의도 떨어지는 것으로 생각된다.
라미부딘과 아데포비어 병합요법에서 치료 반응이 적절하지 않거나 바이러스 내성이 발생하는 경우가 여전히 존재하여, 이에 대한 대책으로 치료성적을 예측할 수 있는 인자에 관한 연구 및 대안 약제에 대한 연구들이 진행되었다. 높은 HBV DNA 수치 및 병합치료 6개월째의 조기 바이러스 반응을 보일수록 치료성적이 좋아, 이를 만족하지 못하는 경우에는 대안약제로의 변경을 고려할 수 있고[10-12], 대안약제로서 엔테카비어와 아데포비어의 병합치료 또는 테노포비어(tenofovir disoproxil fumarate)의 효과가 우수함을 증명하는 연구들이 있었다[10,17-20]. 본 연구는 라미부딘과 아데포비어 병합요법을 선택한 환자군에 대한 후향적 연구로서, 환자군을 분석한 결과 간경변증 환자는 34.2%로 적었고, 그 중에서도 CTP class A에 속하는 환자는 81.8%, CTP class B에 속하는 환자는 18.2%, 그리고 CTP class C에 속하는 환자는 단 한 명도 없었던 점을 미루어 보아, 간경변증, 특히 비대상성 환자에서는 추적관찰 중 바이러스 증식의 악화를 보일 경우에 조기에 보다 효과적인 다른 약제로 변경하였음을 확인할 수 있었다. 그러나 새로운 병합약제의 도입에는 경제적인 제한점이 따르고, 본 연구의 대상 환자를 수집한 시기는 현재 가장 강력한 약제로 알려진 테노포비어의 국내 도입이 아직 되지 않았던 시기로, 상대적으로 간의 잔여기능이 유지되는 환자군에 대해서는 라미부딘과 아데포비어의 병합치료 군에서 해당 치료를 유지하면서 치료성적 예측인자를 고민하는 것이 의미 있는 일이었다.
본 저자들은 6개월째 조기 바이러스 음전을 이루지 못하여도 이후 지연된 음전을 보이면서 장기적인 치료효과를 유지하였던 임상적 경험을 바탕으로, 12개월째의 지연된 바이러스 음전에 영향을 미치는 인자를 조사하였다. 이를 토대로 초기 6개월째 바이러스 음전이 되지 않아 다른 약물로 빨리 전환하기보다는, 환자별로 본 연구에서 제시한 대로 병합치료 시점의 낮은 HBV DNA 수치, HBeAg 음성 여부, 성별(여성)을 평가하여 병합 사용을 좀 더 유지하면서 바이러스 반응을 기대해 볼 수 있을 것이다. 낮은 HBV DNA 수치 및 HBeAg 음성 여부는 다른 연구들에서도 바이러스 반응의 중요한 예측인자로 보고되었는데, 이는 증식하는 바이러스의 부하가 적을수록 약제에 대한 바이러스 반응이 좋기 때문으로 사료된다[5,6,16,21]. 여성에서 약제에 대한 바이러스 반응이 좋음은 Toyama 등[16]의 연구에서도 같은 결과를 보였으나, 정확히 여성에서의 어떤 인자가 바이러스 반응에 영향을 미치는가에 대한 기전은 알려지지 않았다.
라미부딘 내성 돌연변이의 종류가 아데포비어 병합치료성적에 영향을 미친다는 다른 연구[22]와 달리, 본 연구에서는 돌연변이의 종류가 병합치료성적에 영향을 미치지 않았다. 또한 바이러스 증식과 관련되지 않은 혈청 ALT 상승이 항바이러스 치료성적을 향상시킨다는 다른 연구[23,24]와 달리 본 연구에서는 혈청 ALT 수치가 병합치료성적에 영향을 미치지 않았는데, 이는 본 연구에서 3개월 간격으로 혈청 HBV DNA와 ALT를 긴밀히 추적관찰하여 상승 여부를 조기에 발견하였기 때문이라고 생각된다. 6개월 조기 바이러스 반응결과가 장기치료 반응 및 내성 발생을 예측한다는 이전의 연구들[10-12]이 이미 나와 있는 반면에, 12개월 지연 바이러스 반응을 보인 환자의 장기치료성적 및 아데포비어 내성 발생과의 관계에 대해서 직접적으로 연구된 바가 없어 이를 확인하는 추가적인 연구가 필요하다.
본 연구는 후향적 연구로 대규모의 무작위 배정을 통한 전향적인 연구가 진행되지 못하였던 점이 아쉽다. 하지만 최근 더욱 강력한 항바이러스 효과를 가진 테노포비어를 포함한 치료전략이 라미부딘 내성을 극복하는 데 있어 아데포비어보다 효과적인 것으로 알려지고[9,25], 테노포비어가 2013년부터 한국에서도 승인됨에 따라 테노포비어 제제로의 변경 또는 병합치료성적과 관련된 대규모의 전향적 연구결과를 기다려야 하는 시점이다. 그러나 좀 더 효과적인 새로운 약제의 내성 발생을 줄이기 위해서는 새로운 약제들의 무분별한 사용보다는 과거에 개발된 약제의 처방을 유지하고 있는 환자들에서 임상경과를 악화시키지는 않으면서 기존 약제의 효과를 최대한 이용할 수 있는 법을 개발하여야 한다. 라미부딘 내성 환자에서 아데포비어 병합 사용을 안전한 범위에서 좀 더 오래 유지할 수 있는 방법을 제시하는 것이 본 연구의 의의라 하겠다.
결론적으로, 라미부딘 내성을 보이는 만성 HBV 간염 환자에서 구원치료로 아데포비어를 병합하여 사용할 때, 환자가 여성이거나, 병합치료 시작 시점에서 HBV DNA 역가가 낮은 경우, 또는 병합치료 시작 시점의 HBeAg가 음성인 경우에는 비록 초기 6개월째에 병합치료의 반응이 좋지 않다 하더라도 12개월째에는 치료 반응을 획득할 수 있을 것으로 예측하여 치료를 유지해볼 수 있을 것으로 생각된다.
Fig. 1Patients who has achieved IVR at 6 months and their acquisition or failure of delayed virologic response at 12 months after ongoing combination treatment of lamivudine-adefovir for further 6 months. HCV, hepatitis C virus; HIV, human immunodeficiency virus; IVR, initial virologic response. 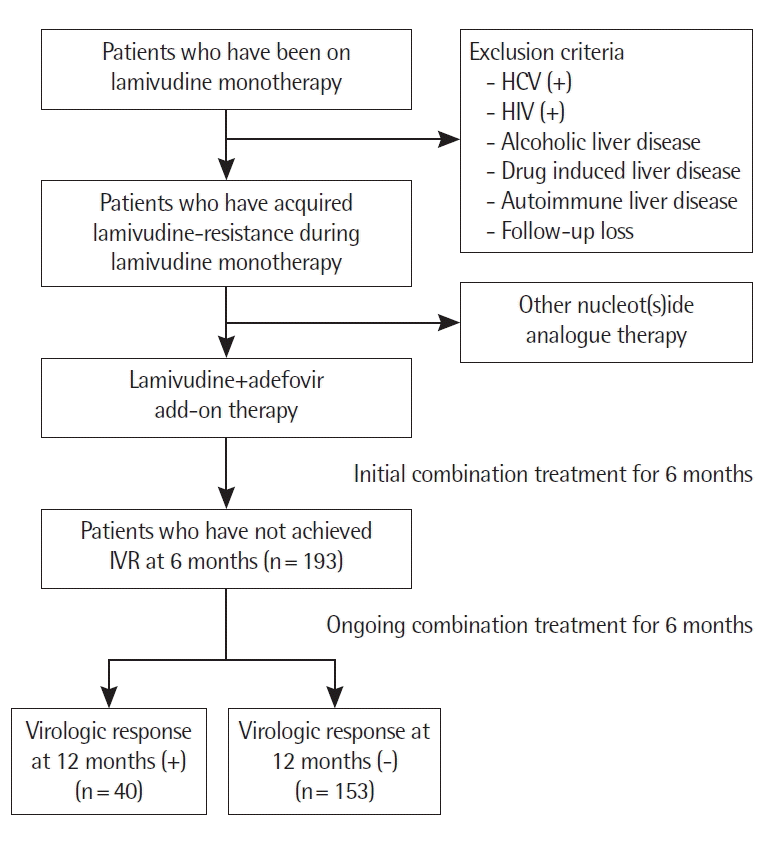
Table 1Baseline characteristics
HBV, hepatitis B virus; CTP, Child-Turcotte-Pugh; LAM, lamivudine; AST, aspartate aminotransferase; ALT, alanine aminotransferase; rtM204V, methionine to valine at reverse transcriptase codon 204; rtM204I, methionine to isoleucine at reverse transcriptase codon 204; rtM204V+rtL180M, methionine to valine at reverse transcriptase codon 204 plus leucine to methionine at reverse transcriptase codon 180; rtM204I+rtL180M, methionine to isoleucine at reverse transcriptase codon 204 plus leucine to methionine at reverse transcriptase codon 180; rtM204V/I+rtL180M, methionine to valine plus methionine isoleucin at reverse transcriptase codon 204 plus leucine to methionine at reverse transcriptase codon 180. Table 2Univariate and multivariate logistic regression analysis about predictive factors for delayed HBV clearance at 12 months of adefovir add-on therapy with ongoing LAM therapy in LAM-resistant chronic hepatitis B patients
REFERENCES1. Lai CL, Dienstag J, Schiff E, Leung NW, Atkins M, Hunt C, et al. Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B. Clin Infect Dis 2003;36: 687-96.
2. Lee JM, Park JY, Kim do Y, Nguyen T, Hong SP, Kim SO, et al. Long-term adefovir dipivoxil monotherapy for up to 5 years in lamivudine-resistant chronic hepatitis B. Antivir Ther 2010;15: 235-41.
3. Kim HJ, Park JH, Park DI, Cho YK, Sohn CI, Jeon WK, et al. Rescue therapy for lamivudine-resistant chronic hepatitis B: comparison between entecavir 1.0 mg monotherapy, adefovir monotherapy and adefovir add-on lamivudine combination therapy. J Gastroenterol Hepatol 2010;25: 1374-80.
4. Ryu HJ, Lee JM, Ahn SH, Kim do Y, Lee MH, Han KH, et al. Efficacy of adefovir add-on lamivudine rescue therapy compared with switching to entecavir monotherapy in patients with lamivudine-resistant chronic hepatitis B. J Med Virol 2010;82: 1835-42.
5. Chung GE, Kim W, Lee KL, Hwang SY, Lee JH, Kim HY, et al. Add-on adefovir is superior to a switch to entecavir as rescue therapy for Lamivudine-resistant chronic hepatitis B. Dig Dis Sci 2011;56: 2130-6.
6. Sheng YJ, Liu JY, Tong SW, Hu HD, Zhang DZ, Hu P, et al. Lamivudine plus adefovir combination therapy versus entecavir monotherapy for lamivudine-resistant chronic hepatitis B: a systematic review and meta-analysis. Virol J 2011;8: 393.
7. Lee SJ, Yim HJ, Hwang SG, Seo YS, Kim JH, Yoon EL, et al. Treatment of lamivudine-resistant chronic hepatitis B infection: a multicenter retrospective study. Scand J Gastroenterol 2013;48: 196-204.
8. Yim HJ, Seo YS, Yoon EL, Kim CW, Lee CD, Park SH, et al. Adding adefovir vs. switching to entecavir for lamivudine-resistant chronic hepatitis B (ACE study): a 2-year follow-up randomized controlled trial. Liver Int 2013;33: 244-54.
9. Korean Association for the Study of the Liver. KASL clinical practice guidelines: management of chronic hepatitis B. Clin Mol Hepatol 2012;18: 109-62.
10. Ong A, Wong VW, Wong GL, Chan HY, Tse CH, Chan HL. Management options for lamivudine-resistant chronic hepatitis B patients with suboptimal virological suppression by adefovir. Aliment Pharmacol Ther 2011;34: 972-81.
11. Kim YJ, Paik SW, Sinn DH, Gwak GY, Choi MS, Lee JH, et al. Viral response at 6 months is associated with treatment outcome of adefovir add-on therapy for lamivudine-resistance. J Gastroenterol Hepatol 2012;27: 1454-60.
12. Seto WK, Liu K, Fung J, Wong DK, Yuen JC, Hung IF, et al. Outcome of lamivudine-resistant chronic hepatitis B after up to 5 years of combination therapy with adefovir. Antivir Ther 2012;17: 1255-62.
13. Lok AS, Lai CL, Leung N, Yao GB, Cui ZY, Schiff ER, et al. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterology 2003;125: 1714-22.
14. Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, et al. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Lamivudine Clinical Investigation Group. Hepatology 1998;27: 1670-7.
15. Lampertico P, Marzano A, Levrero M, Santantonio T, Di Marco V, Brunette M, et al. Adefovir and lamivudine combination therapy is superior to adefovir monotherapy for lamivudine-resistant patients with HBeAg-negative chronic hepatitis B. J Hepatol 2007;46(Suppl 1):S191.
16. Toyama T, Ishida H, Ishibashi H, Yatsuhashi H, Nakamuta M, Shimada M, et al. Long-term outcomes of add-on adefovir dipivoxil therapy to ongoing lamivudine in patients with lamivudine-resistant chronic hepatitis B. Hepatol Res 2012;42: 1168-74.
17. Chae HB, Kim MJ, Seo EG, Choi YH, Lee HS, Han JH, et al. High efficacy of adefovir and entecavir combination therapy in patients with nucleoside-refractory hepatitis B. Korean J Hepatol 2012;18: 75-83.
18. Ha M, Zhang G, Diao S, Lin M, Wu J, Sun L, et al. Rescue therapy for lamivudine-resistant chronic hepatitis B: adefovir monotherapy, adefovir plus lamivudine or entecavir combination therapy. Intern Med 2012;51: 1509-15.
19. Zhao P, Wang C, Huang L, Xu D, Li T. Comparison of rescue strategies in lamivudine-resistant patients with chronic hepatitis B. Antiviral Res 2012;96: 100-4.
20. Cho Y, Lee DH, Chung KH, Jin E, Lee JH, Cho EJ, et al. The efficacy of adefovir plus entecavir combination therapy in patients with chronic hepatitis B refractory to both Lamivudine and adefovir. Dig Dis Sci 2013;58: 1363-70.
21. Shin SR, Koh KC, Gwak GY, Choi MS, Lee JH, Paik SW, et al. A low viral load predicts a higher initial virologic response to adefovir in patients with Lamivudine-resistant chronic hepatitis B. Gut Liver 2010;4: 530-6.
22. Kim HJ, Park JH, Park DI, Cho YK, Sohn CI, Jeon WK, et al. The influence of YMDD mutation patterns on clinical outcomes in patients with adefovir add-on lamivudine combination treatment. Liver Int 2012;32: 303-10.
23. You H, Wu X, Ou X, Ma H, Wang Q, Liu T, et al. Two patterns of alanine aminotransferase increase to predict long-term viral response in chronic hepatitis B patients: virus- or host-induced? Antivir Ther 2011;16: 299-307.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||