서 론
변연뇌염은 단기 기억력장애와 지남력장애, 뇌전증 및 행동변화가 주증상으로, 수일 혹은 수주에 걸쳐서 빠르게 진행하며, 뇌 자기공명영상(magnetic resonance imaging, MRI)에서 내측측두엽의 부종과 함께 액체감쇠역전회복(fluid attenuated inversion recovery)영상에서 신호 강도의 증가를 보인다[1]. 변연뇌염은 일반적으로 소세포폐암, 고환암, 유방암 등과 관련된 신생물딸림증후군과 헤르페스뇌염과 같은 감염에 의한 원인이 많이 알려져 있으나, Korsakoff 증후군, Hashimoto 뇌염 및 루푸스와 같은 자가면역질환, 독성 혹은 대사성 뇌병증의 질환과 감별하여야 하고, 최근에는 자가신생물딸림항체는 음성이나 면역억제치료에 반응을 하는 변연뇌염이 보고되기도 하여 원인에 대한 다양한 접근이 필요하다. 정확한 초기 진단이 중요하기 때문에 기억력장애를 비롯한 인지기능이상에 대한 정밀한 평가와 함께 변연계의 손상 여부를 직접적으로 확인할 수 있는 영상학적 검사의 시행이 필수적이다[2,3]. 최근 18fluoro labelled deoxyglucose (18FDG)를 이용한 양전자방출단층촬영(positron emission tomography, PET)이 도입되면서 변연뇌염의 진단에 도움을 주는 것이 확인되었으며[4-9], 또한 표준화된 신경심리검사의 발달로 미세한 인지기능이상을 발견할 수 있는 기회가 늘어났다. 저자들은 변연뇌염으로 진단받은 2명의 환자에 대해서 MRI와 18FDG-PET을 시행하여 공통 병변이 있는지를 확인하였고, 신경심리검사의 결과를 비교하여 인지기능이상과 영상학적 검사 간의 관계를 알아보고자 하였다. 또한 추적검사를 실시하여 질환의 경과에 따른 변화 양상을 파악하고자 하였다.
대상 및 방법
1. 대상
2009년 9월부터 2011년 12월까지 신경과를 방문한 환자 중 Graus 등[10]이 제시한 진단기준에서 가능성 있는(possible) 신생물딸림 변연뇌염의 진단기준에 합당하고, 전신성 종양의 존재와 종양에 의한 직접적인 뇌손상이 배제된 2명의 환자를 대상으로 전향적 연구를 시행하였다. 즉 1) 변연계의 병변을 시사하는 단기 기억력장애, 경련, 이상행동의 주증상이 급성 혹은 아급성으로 발생하였고, 2) 뇌척수액검사에서 중추신경계의 염증을 시사하는 소견이 관찰되며, 3) 뇌 MRI 혹은 18FDG-PET과 같은 영상검사에서 변연계 병변이 확인되었다. 또한 뇌척수액검사와 MRI에서 다른 원인을 생각할 수 있는 경우는 제외하였다. 대상 환자 2명은 각각 40세, 81세로 모두 오른손잡이 남자였다. 40세 환자는 과거에 고혈압, 당뇨병, 고지혈증, 뇌졸중, 심혈관계질환이나 다른 정신질환의 과거력 및 기타 약물복용은 없는 상태였고, 81세 환자는 고혈압의 병력과 항고혈압약제 복용력이 있으나 건강한 상태였다.
2. 뇌 영상검사
대상군을 질환의 경과에 따라 급성기와 안정기로 분류하여 각 시기마다 뇌 MRI와 18FDG-PET을 시행하였다. 급성기 검사는 입원 후 1주 이내 시행되었고, 안정기는 입원 후 3개월로 정의하였다. 40세 남자 환자(patient 1)는 응급실 내원 당시 급성 뇌병변의 감별진단을 위하여 급성기 뇌 전산화단층촬영(computed tomography, CT)이 시행되었고, 81세 환자(patient 2)는 개인적인 문제로 인하여 3개월 후 추적 뇌 MRI 검사를 시행하지 못하였다. MRI는 1.5-Telsa MRI scanner (Signa HDxt; GE Healthcare, Milwaukee, WI, USA)를 사용하였다. 18FDG-PET 영상은 이중검출기(dual head detector)가 장착된 장비(Biograph2, Simens, Germany)를 이용하였다. MRI 검사는 해당 기관의 영상의학과 전문의 1인이 환자에 대한 임상정보 없이 판독한 결과에 따르고, 18FDG-PET은 MRI의 경우와 동일한 조건하에서 핵의학과 전문의 1인이 판독하였다. 또한 모든 검사는 3명의 신경과 전문의가 추가 검토하였다.
3. 신경심리검사
대상군을 질환의 경과에 따라 급성기와 안정기로 분류하여 각 시기마다 자세한 신경심리검사(Seoul Neuropsychological Screening Battery [SNSB] Korean version of Rey-Kim memory test)를 실시하였다. 모든 신경심리검사는 구조적, 기능적 뇌영상의 결과를 반영하고 결과를 비교할 수 있도록 뇌 MRI와 18FDG-PET을 시행한 시기로부터 1주 내에 시행하였다. 동일한 한 명의 검사자에 의하여 대상군의 모든 신경심리검사가 실시되었다. 검사 항목으로는 주의력(digit span), 언어 및 관련 기능(스스로 말하기, 알아듣기, 따라말하기, 이름대기, 쓰기, 읽기, 계산, 좌우 지남력, 신체부위인지검사, 그리고 실행증검사), 시공간능력(오각형 겹쳐 그리기, 레이-복합도형), 언어적 기억력(서울언어학습검사 중 즉각회상, 지연회상, 재인검사), 비언어적 기억력(레이-복합도형에 대한 즉각회상, 지연회상, 재인검사), 전두엽기능(contrasting program, go-no-go test, fistedge-palm, alternating hand movement, alternating square & triangle, Luria loop, controlled oral word association test, Koreancolor word stroop test)을 포함하였다. 언어 검사 중 자세한 이름대기검사를 위해 Korean version of Boston naming test를 사용하였다. 이외에 한국형 간이신경검사(Korean version of mini-mental state examination)와 global deterioration scale을 이용하여 전반적인 인지기능을 평가하였고, 우울증 여부를 확인하기 위하여 한국판 노인 우울증 척도(geriatric depression scale-K)를 사용하였다. 한국형 간이신경검사를 비롯한 모든 신경심리검사결과는 나이와 연령 및 학력을 보정한 국내 기준을 사용하여 정상과 비정상적인 환자 수를 산출하여 비교 분석하였다[11].
결 과
1. 대상 환자의 임상적 특징
2명의 환자는 모두 급성으로 발병하였고, 빠르게 진행하는 기억장애를 주증상으로 내원하였다. 단기 기억장애가 현저한 양상이었고 지남력장애와 이름대기장애가 동반되었다. 40세 남자 환자(patient 1)는 밤에도 잠을 자지 않고 안절부절못하는 격정성 행동장애가 관찰되었으며, 81세 남자 환자(patient 2)는 기억력장애와 함께 작화증을 보였으나 환각과 망상은 없었다. 2명의 환자는 1주 이내 갑자기 발생하였다가 수초 혹은 수분 내로 호전되는 사지의 간헐적인 근경련을 시사하는 증상이 있었으나 내원 당시에는 관찰되지 않았다. 내원 당시 신체징후는 정상이었고, 신체검사와 신경학적 검사는 모두 정상이었다. 감별 진단을 위한 뇌척수액검사 중 2명의 환자에서 공통적으로 경미한 단백질 상승소견이 관찰되었으나 단순 헤르페스바이러스를 비롯한 엡스타인-바바이러스(Epstein-Barr virus), 수두대상포진바이러스에 대한 항체와 중합효소 연쇄반응(polymerase chain reaction, PCR)검사는 음성이었고, 일본뇌염바이러스와 인간헤르페스바이러스-6 (human herpes virus-6)에 대한 평가는 여건상 시행하지 않았다. 혈액검사와 일반화학검사 및 요검사는 모두 정상이었으며, 흉부 및 복부 단순방사선촬영에서 특이소견은 없었다. 또한 항핵항체, 항갑상선미세소체항체, 갑상선 글로불린항체는 음성이었다.
초기 헤르페스뇌염의 가능성이 충분히 배제되지 않았기 때문에 2주 동안 acyclovir를 정주 치료를 시행하였다. 항바이러스제 치료중에도 임상증상의 호전이 없어서 고용량 스테로이드를 정맥 투여하였고, 이후 경구 스테로이드 치료를 지속적으로 유지하였다. 내원 1주 후 시행된 추적 뇌척수액검사에서도 경미한 단백질 상승소견은 지속되었으나, 헤르페스 PCR 검사는 음성이었다(Table 1). 환자 모두에서 급성기 MRI 및 18FDG-PET 시행 1일 전 뇌파검사를 시행하였으나 전반적인 서파 외에 측두엽의 뇌전증모양방전(epileptiform discharge)은 관찰되지 않았다. 또한 치료 시작과 함께 신생물딸림증후군의 원인이 될 수 있는 전신성 종양을 찾기 위해 전신 18FDG-PET과 복부내시경, 위내시경 및 대장내시경을 시행하였으나 모두 정상이었다. 3개월 후 추적 뇌영상검사를 실시할 때 환자의 기억력장애는 호전되지 않은 상태였으며, 동반된 지남력장애와 이상행동의 양상 또한 지속되는 상태였다.
2. 뇌 영상분석
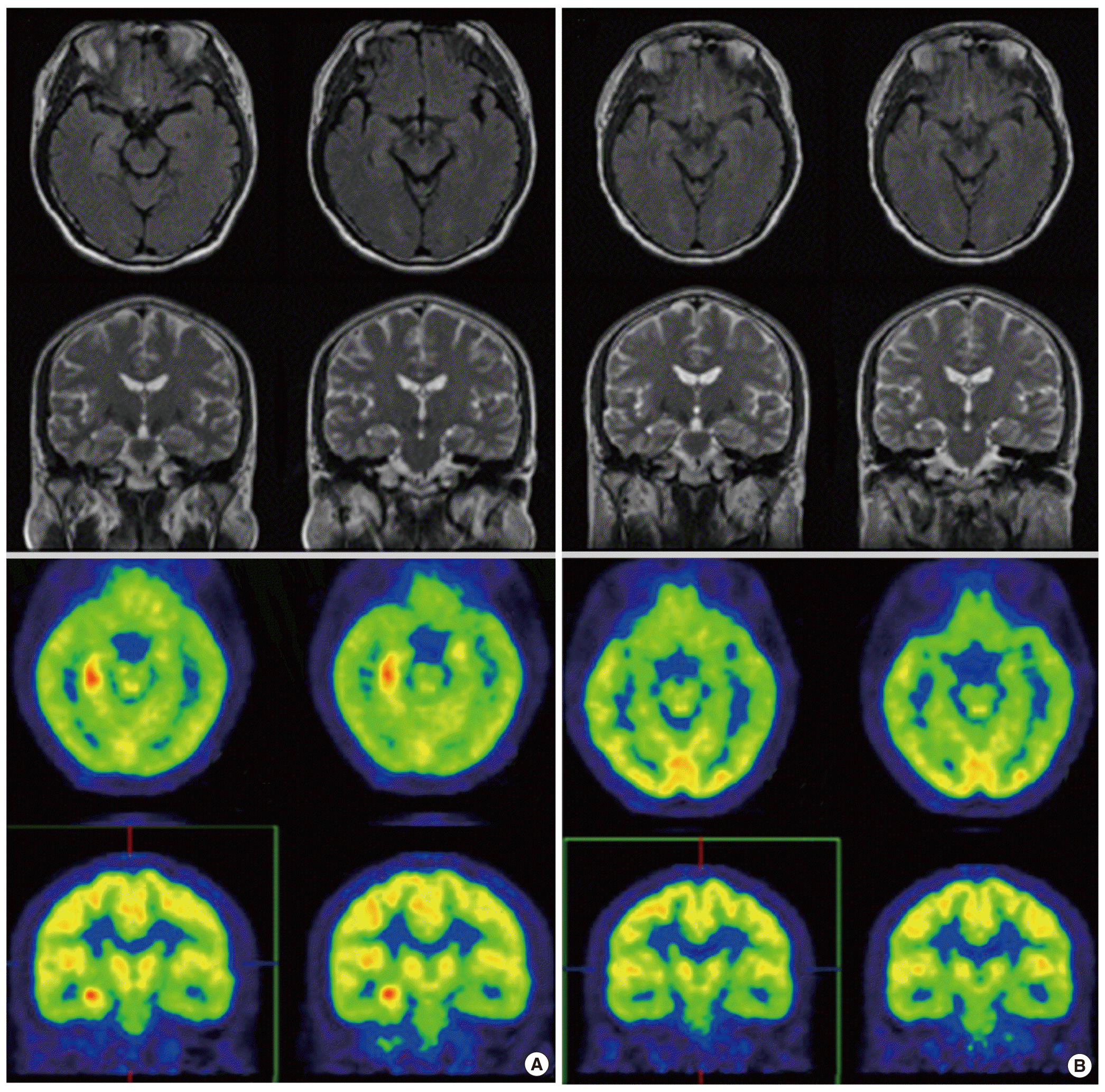
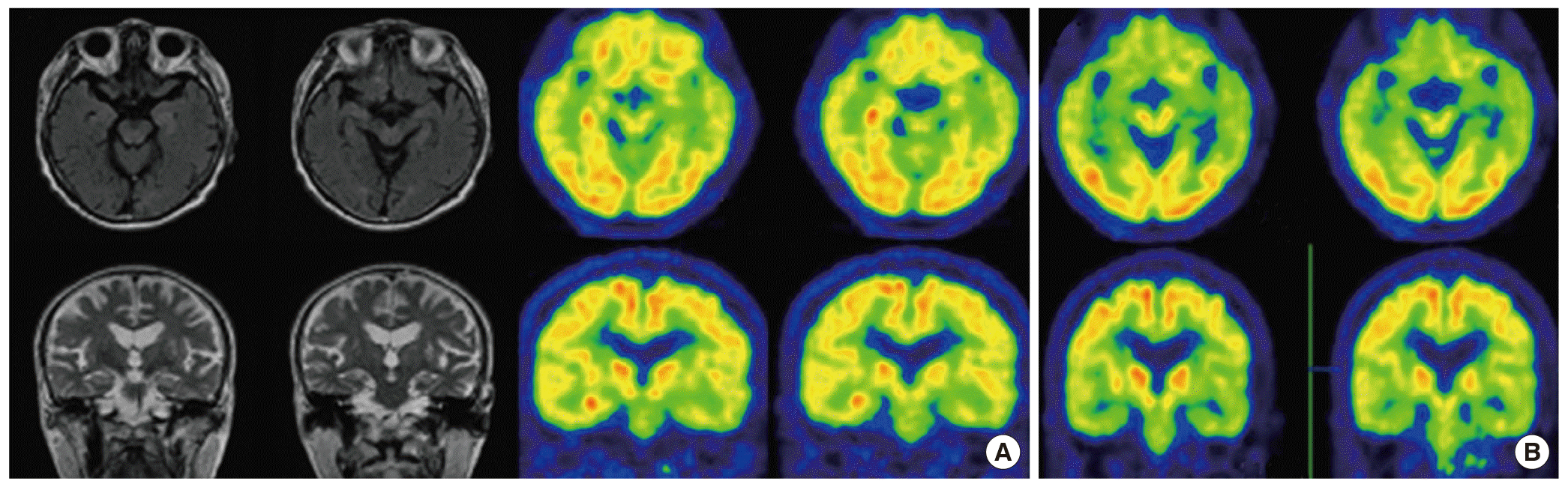
대상군에서 T1- 및 T2-강조영상과 gadolinium으로 조영하여 촬영한 T1-강조영상을 포함한 급성기 뇌 MRI에서 이상소견은 관찰되지 않았다. 81세 남자 환자(patient 2)에서 경미한 허혈성 뇌손상과 전반적인 대뇌피질의 위축이 경미한 정도로 관찰되었으나 연령 및 고혈압의 병력을 고려할 때 현재의 증상과 의미 있는 관련성은 없는 것으로 판단하였다. 급성기 18FDG-PET 검사결과 해마를 포함한 우측 내측 측두엽의 현저한 당 대사증가(glucose hypermetabolism)가 환자 2명에서 공통적으로 관찰되었다(Figs. 1, 2). 3개월 후 추적 18FDG-PET을 시행한 결과 양측 내측 측두엽의 당 대사는 심하게 저하되어 있었다(Figs. 1, 2). 40세 남자 환자(patient 1)에서 3개월 후 추적 뇌 MRI를 시행하였고, 급성기 소견과 다르게 양측 내측 측두엽이 위축된 상태가 관찰되었다(Fig. 1).
3. 신경심리검사
2명의 변연뇌염 환자들의 신경심리검사결과를 나이, 연령 및 학력을 보정한 국내 정상 기준을 적용한 후 판독하였다. 다만 국내 정상 기준치에 대한 자료부족으로 인하여 40세 환자(patient 1)는 55세, 81세 환자(patient 2)는 80세에 대한 표준인지기능 기준치와 비교하였기 때문에 정확한 인지기능 평가에 오류가 있을 가능성이 있었다. 대상군은 급성기에 공통적으로 지남력장애와 함께 언어영역과 시공간영역에 대한 심각한 기억장애가 관찰되었고, 이름대기장애가 동반되었으며, 경미한 전두엽기능장애가 관찰되었다. 그 외 주의력과 말하기, 이해하기와 쓰기와 같은 언어기능과 레이-복잡도형베끼기로 확인한 시공간능력은 정상 범위였다. 다만 40세 남자환자에서는 우울증 척도가 24점으로 높게 측정되었고 검사 도중 심하게 불안해하고 초조해하는 증상이 관찰된 반면, 81세 남자에서는 기억력장애와 함께 심한 작화증이 관찰되었다. 3개월 후 추적검사결과를 급성기 검사소견과 비교할 때 전두엽 및 실행기능을 반영하는 검사에서 오류가 더 많이 관찰되었으나, 언어영역 및 시공간영역에서의 기억력장애를 포함한 기타 영역에서의 인지기능에서 의미 있는 변화는 없었다(Table 2).
고 찰
본 연구의 대상 환자에서 헤르페스 뇌염의 가능성을 시사하는 증상은 관찰되지 않았으나 진단 시 급성기 헤르페스 뇌염의 가능성을 충분히 배제할 수 없었기 때문에 항바이러스제 투여를 시작하였다. 항바이러스제의 투여 후에도 증상의 호전은 없었으며, 치료 도중 반복해서 시행한 뇌척수액검사에서 헤르페스 PCR 검사는 모두 음성으로 확인되었다. 이후 자가면역성 변연뇌염의 가능성을 고려하여 시작한 고용량 스테로이드 투여에도 증상 호전은 없었으며, 스테로이드 경구 투여와 함께 azathioprine을 같이 투여하였으나 증상 호전은 없었다. 일반적으로 신생물딸림 신경학적 증후군(paraneoplastic neurological syndrome)의 치료를 시행한 환자들의 수가 적고, 동반된 항암치료를 시행 받고 있는 경우가 많기 때문에 신생물딸림 신경학적 증후군의 다수에서 면역억제치료의 효과는 불분명하다[12]. 또한 종양과 관련이 없는 자가항체와 관련된 변연뇌염에서도 면역억제제의 치료효과 역시 현재까지 충분하게 밝혀져 있지 않다. 따라서 본 연구에서 대상군의 변연뇌염의 원인은 확실하지 않으나, 최종적으로 스테로이드를 비롯한 면역억제제에 반응이 불량한 자가면역성 변연뇌염 혹은 원발성 종양의 진단 전에 발생한 신생물딸림 변연뇌염의 가능성이 높을 것으로 판단된다. 신생물딸림 변연뇌염에서 발병 당시 철저한 검사에도 불구하고 미시적인(microscopic) 원발 종양을 찾지 못하는 사례는 다수 보고되어 있다[1,10,12].
변연뇌염의 초기 진단이 어려운 다른 이유는 주증상인 기억장애, 뇌전증 및 이상행동과 의식변화만으로 다른 질환과 감별하기 어렵다는 것이다. 상대적으로 젊은 연령에서 측두엽 뇌전증과 정신장애, 신경매독과 같은 치료 가능한 치매를 감별해야 하며, 고령의 환자에서 대사성 질환이나 약물중독 등으로 인한 치매나 알츠하이머병과 같은 질환과 오진되는 경우가 많이 보고되어 있다[13]. 나아가 변연뇌염의 가능성을 고려하여 시행한 뇌영상검사와 뇌척수액검사의 결과가 위음성으로 나오는 경우도 많다. 급성기 헤르페스뇌염에서 뇌 CT 및 MRI에서 음성으로 나오는 확률은 30-40%로 보고되어 있으며, 뇌척수액검사에서 음성률은 20%까지 보고되었다[14,15]. 따라서 초기부터 뇌척수액검사와 함께 뇌파검사, 뇌 MRI와 같은 영상검사를 신속하게 시행하여, 변연계의 선택적인 침범을 민감하게 확인할 수 있으며, 임상증상을 좀 더 정확히 반영할 수 있는 기능적 뇌영상검사에 대한 필요성이 증가되고 있다[4,5,9].
일단 전형적인 변연뇌염에서 헤르페스와 같은 감염성 원인이 배제되었다면, 자가면역성 원인의 가능성이 높다고 판단할 수 있다. 일반적으로 자가면역성 원인에서 신생물딸림 신경학적 증후군이 가장 많이 알려져 있었다. 그러나 최근 면역조직학적 연구의 발달과 함께 종양과 관련이 없이 변연계를 선택적으로 침범하는 다양한 자가항체들이 발견되었다. Voltage-gated potassium channel antibody [16], N-methyl-D-aspartate [17], gamma aminobutyric acid [18] 및 α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid 수용체[19]에 대한 항체 등이 알려졌으며, 이러한 자가항체들은 일반적으로 세포형질막 항원에 대한 자가항체로 기능하는 경우가 많다. 반면 변연뇌염과 연관된 종양성신경세포 항원(onconeuronal antigen)은 대체로 세포 내에 존재하는 것으로 알려져 있고, 면역억제치료에 치료 반응이 적은 것으로 추정되고 있다. 또한 다양한 신생물딸림 자가항체 중에서 anti Hu-, Ma2, CV2, amphiphysin 항체는 변연뇌염의 발생과 연관성이 높은 것으로 알려져 있다[20].
다양한 자가항체의 발견은 일반적으로 신생물딸림 신경학적 증후군으로만 알려져 있었던 변연뇌염의 스펙트럼에 큰 변화를 가져오게 되었다. 자가항체가 변연계 뇌염을 분류하는 핵심으로 부상하였고 이에 따른 새로운 분류방법이 제시되고 있다. 이와 같이 자가항체의 특징을 중심으로 분류를 시도하는 경우 세포 내 항원에 대한 항체군과 세포형질막 항원에 대한 항체군으로 크게 나누어 볼 수 있고, 또한 혈청음성군(seronegative group)으로 추가될 수 있다. 이러한 분류와 자가항체를 통한 접근법은 향후 변연뇌염의 치료와 예후의 평가에 도움을 줄 것으로 예측되고 있다.
자가항체가 변연계를 선택적으로 침범하는 기전은 충분히 확인되지 않았다. 또한 자가항체에 따른 임상증상의 차이와 구조적 및 기능적 뇌영상의 차이는 충분히 연구되지 않은 실정이다. 따라서 환자의 증상을 반영할 수 있는 기능적 뇌영상과 함께 표준화된 신경심리검사를 시행하여 인지기능이상의 양상을 구체화하는 것이 자가면역성 변연뇌염의 임상진단에 도움이 될 것으로 생각한다. 따라서 본 연구는 변연뇌염 환자 2명에서 전향적으로 18FDG-PET을 이용한 기능적 뇌영상검사와 함께 SNSB를 이용한 자세한 신경심리검사를 시행하여 각각의 결과를 비교하였다. 본 연구에서와 같이 뇌척수액검사에서 경미한 단백질 상승 이외에 특이소견이 없으며 CT와 MRI를 비롯한 구조적 뇌영상검사에서 변연계의 이상이 확인되지 않은 경우 초기 진단이 매우 어려울 수 있다. 따라서 이와 같은 경우 18FDG-PET에서 급성기 변연계의 기능이상을 확인할 수 있다면 신속한 진단에 큰 도움이 된다.
환자 2명은 공통적으로 우측 내측 측두엽의 당 대사항진소견이 관찰되었는데, 이에 대한 해석에는 아직까지 논란이 많다. 우선 측두엽의 대사항진은 측두엽에서 기원한 뇌전증성 활동(epileptic activity)이나 비경련성 발작 등으로 인한 일시적인 변화로 판단되며 정작 변연계의 염증과는 관련이 없다는 견해가 많다[4,9,21]. 그러나 본 연구에서 18FDG-PET검사 전후 환자의 뇌전증발작을 시사하는 의식의 변화나 갑작스러운 악화는 없는 상태였다. 그리고 현재까지 보고된 초기 변연뇌염에서 18FDG-PET을 시행한 결과 변연뇌염이 확진된 경우의 다수에서 일측 혹은 양측성의 내측 측두엽당 대사항진이 관찰되었었다. 따라서 내측 측두엽의 대사항진은 변연뇌염의 병리와 관련된 염증성 변화로 고려하는 것이 타당하며, 초기에 일측성에서 대사항진되었다가 추적검사 시에는 양측 측두엽에서 모두 저하되었고, 약물치료에도 불구하고 지속되는 심각한 기억장애의 증상과 신경심리검사소견은 염증성 변화가 일측성에서 국한되지 않고, 양측성 및 광범위하게 영향을 주었을 가능성을 제시한다.
급성기 MRI에서 변연계 병변이 확인되고, 동시에 gadolinum 조영 증강이 관찰되는 것은 면역억제제를 비롯한 약물치료에 효과적으로 반응할 수 있는 가능성을 반영하는 것으로 알려져 있다[3,4,8]. 그러나 본 연구에서는 MRI에서 내측 측두엽의 조영증강이 없는 상태였으며, 적극적인 치료에도 불구하고[22] 실제 증상의 호전은 없었다. 따라서 18FDG-PET에서 관찰되는 당 대사항진이 약물치료에 대한 효과와 신경학적 예후에 대한 예측에 도움이 되지 않을 것으로 추정할 수 있다. 또한 급성기 뇌영상검사와 근접한 시기에 시행한 신경심리검사결과 언어영역과 시공간영역에 대한 심한 기억장애가 유사한 정도로 관찰된 반면, 18FDG-PET의 결과는 우측에만 국한된 대사항진이 관찰되었다는 점도 주목할 만하다. 우성반구가 언어영역, 비우성반구가 주로 시공간영역에 대한 기억장애와 연관되어 있다는 연구결과를 단순 적용시킨다면[22,23], 본연구에서처럼 18FDG-PET과 같은 기능적 뇌영상검사는 임상증상보다 늦지만 뇌 MRI보다 빠르게 변연계의 병리를 반영한다고 판단할 수 있다. 그러나 이와 같이 18FDG-PET과 같은 기능적 뇌영상에서 관찰되는 연속적인 내측 측두엽 침범의 임상적 함의가 어떠한 것인지는 현재까지 분명하지 않다[24].
3개월 후 시행한 추적 18FDG-PET 검사에서 대상군 모두 양측 내측 측두엽의 심한 대사저하와 관련된 보고는 현재까지 드물다. 본 연구에서 동일한 시기에 추적 시행한 신경심리검사결과 언어영역과 시공간영역의 기억장애에서 의미 있는 변화는 관찰되지 않았으나 급성기보다 다소 악화된 전두엽 기능장애가 관찰되었다. 이러한 인지기능장애를 직접적으로 반영하는 대뇌피질부의 대사이상은 관찰되지 않았으나 양측 내측 측두엽의 기능저하와 전두엽 기능저하의 관련성이 보고된 연구결과가 알려져 있는바[25] 임상증상과 합당하다고 판단된다. 40세 남자 환자에서 동일한 시기에 시행한 뇌 MRI상 양측 내측 측두엽의 심한 위축소견이 관찰되었고, 18FDG-PET에서 관찰된 양측성 당 대사저하는 변연뇌염의 경과에 따른 병리를 반영한다고 판단된다. 따라서 양측 내측 측두엽의 당 대사저하는 변연뇌염에서 신경학적 후유장애의 정도가 심할 것으로 추정할 수 있는 기준이 될 수 있다.
본 연구의 제한점은 변연뇌염의 원인이 명확하게 밝혀지지 않았고, 자가항체검사를 시행하지 않아 특정한 원인을 가진 변연뇌염환자군에서 본 연구의 결과를 동일하게 적용하기에는 무리가 있을 수 있다. 그러나 실제 변연뇌염의 발생 빈도가 높지 않으며, 초기 진단이 어려울 수 있기 때문에 18FDG-PET과 같은 기능적 뇌영상을 이용한 연구는 현재까지 대개 증례보고의 수준에 그치는 경우가 많았다. 특히 질환의 경과에 따라 추적검사를 시행한 경우는 매우 드물고 국내 보고 또한 없다. 이러한 점에서 본 연구의 의미가 있을 것으로 생각하며 향후 좀 더 많은 환자를 대상으로 한 연구가 필요하다.