관상동맥 내 빛간섭단층촬영술을 활용한 관상동맥 내 석회화 병변의 중재시술 후 경과 예측: 전향적 관찰 연구
The Optical Coherence Tomographic Findings Which Predict Outcome of Calcified Coronary Lesions after Percutaneous Coronary Intervention: A Serial Follow-up Study
Article information
Trans Abstract
Objective
Imaging modalities such as intravascular ultrasonography or computed tomography or angiography have shown limitations in assessing coronary calcification. In this study, we investigated whether quantitative indices of optical coherence tomography (OCT) in calcified lesions are correlated with the late outcome of a coronary stent.
Methods
We consecutively enrolled patients who had more than grade 2 coronary calcification on fluoroscopy. OCT was performed at baseline, immediately after stenting, and at 9 months after stenting. We analyzed qualitative and quantitative characteristics of plaque, calcification, and stent-related indices.
Results
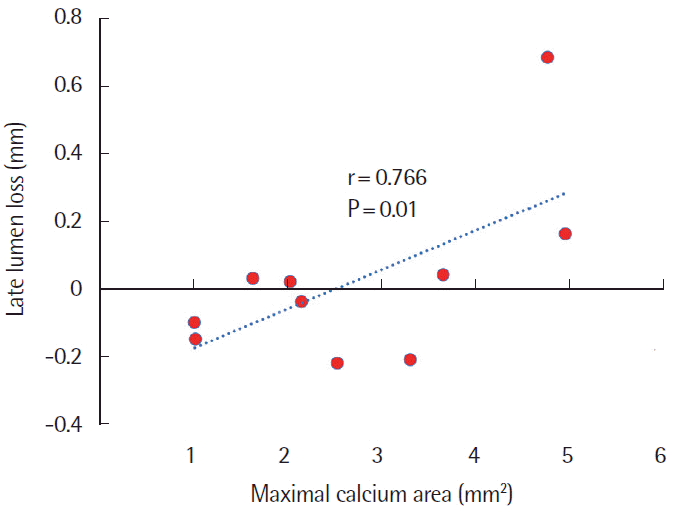
All images of 3-time points were available in a total of 10 patients. Calcified lesions were frequently associated with thin cap fibroatheroma (100%), plaque erosion (20%), or rupture (20%) before the procedure. Thrombus was found in 100% of cases in the OCT immediately after stenting. Maximal calcium area before stenting was strongly correlated with late luminal loss assessed by 9-month follow-up OCT (r= 0.766, P= 0.01).
Conclusion
Preprocedural OCT assessment on calcified coronary lesion may predict high-risk procedure and late stent outcome. Further studies are warranted to confirm these findings.
서 론
관상동맥질환의 재관류 요법은 경피적 관상동맥 중재시술(percutaneous coronary intervention) 및 관상동맥 우회로 이식술(coronary artery bypass graft)으로 나뉜다. 약물 방출 스텐트(drugeluting stent)가 도입된 이후, 이전까지는 시도할 수 없었던 긴 병변, 작은 직경의 병변, 다혈관 병변, 만성폐색병변 및 좌측 주간지의 시술을 효과적으로 할 수 있게 되어 관상동맥질환 치료의 새로운 전기를 맞게 되었다[1,2].
그럼에도 불구하고 석회화 병변은 아직 치료의 난제로 남아있다. 석회화 병변은 불안정성 동맥경화반과 동반되는 경우가 많고, 이에 따라 급성관동맥증후군으로 진행하기 쉽다[3]. 치료를 시도하는 경우에도 통상적인 풍선 도자에 의해 잘 확장되지 않으며, 스텐트를 삽입한다 하여도 스텐트가 잘 펴지지 않은 상태로 혈관 내에 남게되어, 스텐트 재협착 및 스텐트 혈전증의 주요한 원인이 된다[4,5]. 이러한 병변의 위험도에도 불구하고 시술의 성공도 및 환자의 예후를 좌우하는 석회화 동맥경화반의 특징에 관한 연구는 적은 실정이다.
석회화 동맥경화반은 정도가 아주 심한 경우 혈관조영술상으로 관찰할 수 있으나 검사의 민감도가 낮다. 컴퓨터 단층촬영이나 자기공명영상과 같은 기법들은 비침습적이라는 장점이 있지만 실제 환자의 시술 도중에 실시간으로 시행을 할 수가 없고, 미세한 또는 산재되어 있는 석회화 병변의 평가에 제한점이 있다. 관상동맥 내 초음파(intravascular ultrasonography, IVUS)는 현재까지 가장 유용하게 관상동맥 내 동맥경화반의 중증도와 성상을 평가하는 도구였으나 석회화 동맥경화반의 평가 시에 민감도가 떨어지며, 심한 석회화가 동반된 경우에는 artifact에 의해 병변의 평가가 어렵고, 혈관 내 층의 구분이 제한되어 석회화 병변의 깊이를 정확히 평가하기가 어렵다[6,7].
빛간섭단층촬영술(optical coherence tomography, OCT)는 혈관 내 이미징 기법의 하나이다. 파장이 짧은 적외선을 이용하여 해상도가 15 μm로 매우 높기 때문에, 혈관의 미세구조를 평가하는 데 매우 적합한 기법으로 알려져 있다.
OCT는 관상동맥 중재시술을 전 과정에서 유용한 정보를 제공할 수 있다[8]. 시술 전에는 죽상경화반의 형태와 성상을 분석하고, 혈관 크기를 정확하게 측정하여 풍선이나 스텐트의 크기를 결정할 수 있으며, 참고 혈관을 식별하는 데 도움을 준다. 시술 중에는 스텐트의 착지 지검을 결정하고, 스텐트가 적절히 확장되었는지 확인할 수 있게 해준다. 시술 후에는 스텐트 가장자리의 박리, 스텐트의 적절한 부착 및 조직의 스텐트 내 돌출 등을 확인하여 추가 시술 여부를 결정하는 데 도움이 되는 것으로 알려져 있다. 또한 관상동맥 스텐트의 장기 추적관찰 시 유용한 검사방법으로 스텐트 표면의 내피화, 신생내막 및 신생죽상경화 등을 시각화할 수 있어서 관상동맥 스텐트의 장기 추적관찰 시 유용한 검사방법이다[9,10].
OCT와 IVUS를 비교한 연구에서 관상동맥 병변의 특성 및 스텐트의 확장 정도를 평가하는 능력은 비슷한 결과를 보였고, 관찰자 간의 측정오차는 OCT에서 적게 나타났다[11,12]. 그러나 OCT는 높은 해상도로 인해 석회화, 섬유화 및 지질 함유도와 같은 관상동맥 죽상경화반의 조직 특성을 IVUS보다 훌륭하게 파악할 수 있는 것으로 알려졌다[13]. IVUS에서는 초음파는 심한 석회화 병변을 투과하지 못하기 때문에 평가에 제한이 생기는 반면, OCT에서는 뚜렷하게 석회화 병변의 경계를 확인할 수 있어 석회화 병변의 정성적 및 정량적 평가에 유리하다[14].
이에 본 연구에서는 시술 전에 OCT로 관상동맥 내 석회화 소견을 관찰하고, 시술직후와 9개월째에 삽입된 스텐트를 함께 OCT로 분석하여, 석회화의 정량지표와 스텐트의 재협착 정도와의 관련성을 확인하고자 하였다.
대상 및 방법
1. 연구대상
관상동맥조영술상 관상동맥 협착이 관찰되어 약물 방출 스텐트를 사용한 중재시술이 예정되어 있고, 투시 영상(fluoroscopy)에서 쉽게 식별이 가능한 2단계 이상의 석회화가 있는 환자를 대상으로 하였다[15]. 사구체 여과율이 30 mL/min 미만으로 낮거나 스텐트 재협착 병변인 경우 또는 기타 질환으로 예상 수명이 1년 이내인 환자들은 배제하였다.
연구계획 및 프로토콜은 분당서울대학교병원 연구윤리위원회의 심사 및 승인을 받았고(B-1309/217-003), 연구대상자들에게 충분한 정보를 제공한 후 동의서를 취득하였다. 연구자들은 본 연구와 관련된 이해 상충이 없음을 선언하였다.
2. 연구방법
시술 전 관상동맥 내에 OCT 도자(C7 Dragonfly; St. Jude Medical, Saint Paul, MN, USA)를 거치한 후 병변 및 참고 혈관 전후 5 mm를 포함한 부위를 스캔(20 mm/sec)하고, 관상동맥 내 석회화 동맥경화반의 특성(동맥경화반 막의 두께 측정, 지질함량 및 섬유화 정도 평가, 동맥경화반 내 미세혈관 생성 여부, 석회화 각도/길이/단면적) 조사 및 정량적 분석(참고 혈관의 내경, 최소 혈관 내경, 동맥경화반 용적 및 석회화 병변 용적)을 시행하였다. 이후 시술자의 의도에 따라 약물 방출 스텐트를 이용한 중재시술을 시행한 후 종료 직전 OCT를 다시 시행한다. 시술 전 풍선 도자 확장 여부 및 스텐트 삽입 후 추가적인 풍선확장술 여부는 시술자에게 일임하였다. 종료 전 OCT 이미지를 분석하여 잔여 협착 정도, 스텐트 내 동맥경화반 돌출, 혈관 박리 및 스텐트 이상 부착(malapposition) 여부를 확인하였다. 9개월째에 다시 관상동맥조영술을 시행하고, 같은 방법으로 표적 병변에 대하여 신생내막을 포함한 OCT 분석을 시행하였다.
3. 정량적 OCT 분석
LightLab Imaging Inc. (Westford, MA, USA)에서 제공된 소프트웨어를 사용하여 표적 병변의 모든 OCT 영상을 0.5 mm 간격으로 분석하였고, 이전에 기술된 정의에 맞추어 분석하였다[13,16]. 관상동맥 내 석회화 결절반은 시그널이 낮으며 날카로운 경계를 보이는 병변으로, 표적 병변 중 가장 크기가 큰 결절의 최대 단면적, 각도(arc) 및 길이를 측정하였다. 석회화 결절반의 모든 단면적들을 측정하여 용적을 “0.05×(석회화 결절의 각 단면적의 합)”으로 계산하였다[17].
4. 효과 평가 변수 및 평가방법
OCT로 측정한 석회화 병변의 측정값(각도, 길이 및 단면적 등)과 후기 내강 소실(late lumen loss) 간의 관련성을 분석한다. 후기 내강 소실은 “시술 직후 스텐트 최소 직경–9개월째 스텐트 최소 직경”으로 계산한다.
5. 통계분석 원칙 및 방법
정량화된 데이터는 평균 및 표준편차로 제시하고, 카테고리화된 데이터는 빈도 및 백분율로 제시하였다. 시술 직후 및 9개월간 데이터에 비교가 필요한 경우, Wilcoxon signed-rank test를 시행하였다. 상관관계 분석에는 Spearman’s correlation이 사용되었다. 통계프로그램으로는 R ver. 3.0.0 (The R Foundation for Statistical Computing, Vienna, Austria)을 사용하였다.
결 과
2012년 6월부터 2017년 12월까지 두 곳의 심장센터에서 13명의 환자의 시술 전, 시술 직후 및 9개월째 추적 OCT 영상을 얻을 수 있었다. 이 중 3명은 영상 화질이 좋지 않아 영상의 분석이 불가능하여 제외되었다. 대표적 증례의 사진을 Fig. 1에 제시하였다.

(A–C) Representative case of optical coherence tomography (OCT) imaging. (A) Preoperative OCT. (B) Postoperative OCT. (C) 9-Month follow-up OCT.
1. 연구대상자 기본 정보
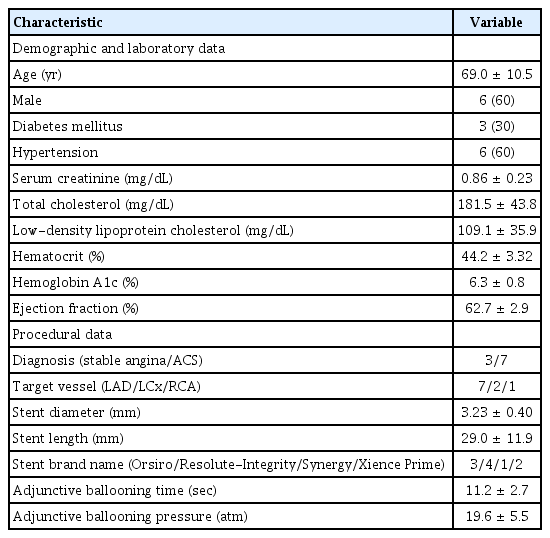
연구대상자의 기본 정보를 Table 1에 정리하였다. 60%의 연구대상자가 남성이고, 30%가 당뇨가 있었고, 70%의 환자가 급성관동맥증후군 소견을 보였다. 표적 병변이 좌전하행지에 있었던 경우가 70%에 달하였다.
2. 시술 전 OCT 소견
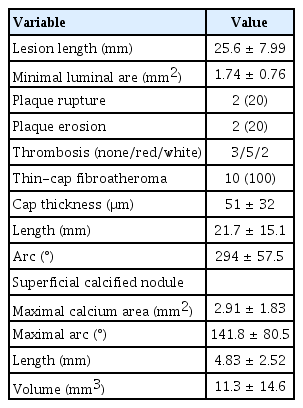
시술 전 OCT 소견을 Table 2에 제시하였다. 죽상경화반의 파열 및 미란이 각각 20%에서 동반되었고, 모든 환자에서 취약한 경화반의 특성인 얇은 섬유막 경화반(thin-cap fibroatheroma, TFCA)가 관찰되었다. 석회화 병변 또한 전체 연구대상자에서 관찰되었고, 최대 단면면적은 약 2.9 mm2, 최대 각도(arc)는 약 140°, 석회화 병변의 용적은 약 11 mm3으로 측정되었다.
3. 시술 직후 및 9개월 추적관찰 시 OCT 소견
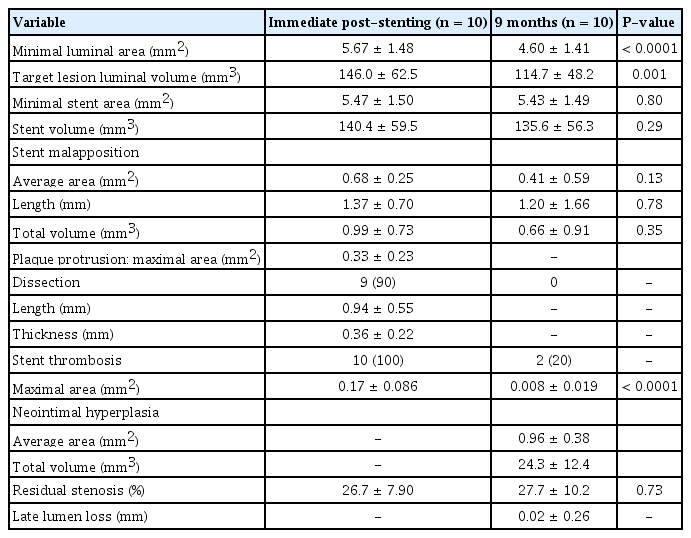
9개월 추적관찰 기간에 급성심근경색, 긴급한 재시술 및 심장 급사 등의 사건은 연구대상자에서 관찰되지 않았다. OCT 분석 데이터를 Table 3에 자세하게 정리하였다. 표적 병변의 최소 내경 단면적 및 내경 용적은 9개월 추적관찰 시 시술 직후에 비해 감소하는 소견을 보였으나, 최소 스텐트 단면적 및 스텐트 내경 용적에는 차이가 없었다.
Optical coherence tomography findings at immediate post-stenting and 9 months after percutaneous coronary intervention
시술 직후에는 스텐트 삽입부에 혈관 박리가 90%에서 관찰되었으나, 9개월째에는 모두 소실되었고, 스텐트 내 혈전도 시술 직후에는 100%에서 나타났지만, 9개월째에는 20%로 감소하는 양상을 보였다. 시술 직후 스텐트 직경 대비 잔여 협착이 20% 이상인 환자가 5명이었고, 평균 잔여 협착률은 26.7%였다. 후기 내강 소실의 평균은 약 0.02 mm였다.
석회화 결절의 정량화 지표들과 후기 내강 소실의 상관분석에서, 최대 단면적만이 후기 내강 소실과 강력한 상관관계를 보였고, 통계적으로 유의하였다(r= 0.766, P= 0.01) (Fig. 2). 칼슘 결절의 각도(r= 0.546, P= 0.10) 및 길이(r= 0.499, P= 0.14)는 중등도의 상관관계를 보였으나 통계적으로 유의하지 않았다.
고 찰
본 연구에서는 석회화 병변이 심한 관상동맥질환 환자를 대상으로 시술 전 OCT 영상을 얻고, 시술 직후 및 9개월째 OCT 영상을 비교하여, 시술 전의 석회화 병변의 어떠한 특성들이 스텐트의 경과에 미치는지 분석을 하였다.
비록 소수의 환자를 대상으로 분석을 하였지만, 이러한 환자들이 시술 직후에도 스텐트가 이상적으로 확장되지 않고, 반 수에서는 20% 이상의 잔여 협착을 보이는 것을 확인할 수 있었다. 그렇지만 약물 방출 스텐트의 우수한 성능에 힘입어 9개월째에 후기 내강 소실의 평균값은 극히 낮았고, 재시술이 필요한 환자는 없었다. 또한 이 연구에서는 심한 석회화 소견이 있는 환자들은 고위험 소견인 TFCA나 관상동맥 내 혈전이 상당수에서 동반되는 것을 관찰할 수 있었다. 즉 투시 영상에서 석회화 소견이 관찰되는 환자들은 석회화뿐만 아니라 다른 위험 소견이 함께 동반될 가능성이 높음을 인지하고, 사전에 고위험 시술에 대비해야 할 것으로 생각된다.
Kobayashi 등[18]은 약물 방출 스텐트 삽입 직후의 확장 정도는 표적 병변에 있는 석회화 병변의 각도(arc)와 면적에 영향을 받는다는 것을 제시하였고, Matsuhiro 등[19]은 석회화 병변의 최대 두께가 독립적으로 적절한 스텐트 확장을 예측할 수 있음을 보여준 바가 있다. 그러나 이 연구들은 모두 시술 전 OCT 소견을 바탕으로 시술 직후의 스텐트 확장을 예측할 수 있는지를 확인한 연구들로, 추적관찰 데이터는 포함되어 있지 않다는 제한점이 있다. 본 연구에서는 시술 전에 시행한 OCT 소견과 스텐트의 후기 경과의 관련성을 비교한 점에서 차별성을 가질 수 있다. 본 연구에서 다른 지표보다 석회화 단면적이 스텐트 후기 내강 소실과 강력한 상관관계를 보였는데, 전체적인 석회화 정도보다 특정 부분에 크게 자리잡은 칼슘이 스텐트 확장의 방해물이 된다는 것을 시사한다.
기존 연구에서 OCT로 평가한 석회화 병변의 면적은 황금률 검사인 조직학적 소견과 유의하게 비례하였고, IVUS보다 유의한 민감도 및 특이도를 보였다[20]. 그러므로 심한 석회화 병변에서 시술 전에 OCT로 사전 평가를 하는 것은 스텐트의 확장 정도 및 고속회전 죽상반 절제술(rotablation) 등의 전처치가 필요한 환자를 예측하는 데 도움이 될 것으로 생각된다. 그러나 현재까지는 석회화 병변이 심한 환자에서 OCT 카테터가 병변을 통과하기 어려운 경우가 많고, 이러한 환자군은 신기능이 떨어져 있는 경우도 많아서 다량의 조영제 사용이 필요한 OCT 검사가 제한이 되는 경우가 많은 실정이다. 고위험 환자에서 시술 전 평가가 보다 가능해질 수 있도록 OCT 영상기법의 개선도 필요해 보인다.
본 연구는 10명의 환자만을 대상으로 하여 결과를 일반화하기 어려운 제한점이 있다. 연구 진행 중 관상동맥 석회화가 심한 환자들의 비율이 높지 않았고, OCT에 대한 인식이 낮아 연구에 대한 동의율이 낮아서 환자의 등록에 어려움이 있었다. 또한 일부 환자들(n=3)은 9개월 추적 OCT까지 수행하였으나, 화질이 이미지 분석에 적합하지 못하였다. 그러나 소수의 환자일지라도 전체 표적 병변을 0.5 mm 간격으로 심도 있게 분석하여 정량적 및 정성적 평가를 충분히 수행하였기에 이 연구의 결과는 추후 대규모 연구의 가설을 세우는 데 도움이 될 것으로 생각된다.
결론적으로, 관상동맥 석회화 병변에서 시술 전 OCT로 관찰한 석회화 지표는 스텐트의 후기 경과와 상관관계가 있다.
Acknowledgements
이 연구는 2012년도 분당서울대학교병원 신진연구비 지원을 받아수행되었다(04-2012-001).