흉추 경막외마취가 Sevoflurane 마취 중 고탄산혈증으로 인한 혈역학적 변화에 미치는 영향
Effects of Thoracic Epidural Anesthesia on Hemodynamic Changes Induced by Hypercapnia during Sevoflurane Anesthesia
Article information
Trans Abstract
Objective
Many studies have demonstrated that carbon dioxide has direct depressive effects on the myocardium and dilates the vascular bed. However, it leads to an increase in arterial blood pressure and cardiac output because of sympathetic stimulating effect. Extensive epidural block may impair the sympathetic innervation to the heart as well as to the adrenal gland. The present study was set up in order to investigate how an extensive epidural block would affect the hemodynamic response to sympathetic stimulation induced by hypercapnia.
Methods
Twenty patients were mechanically ventilated under general anesthesia after epidural catheter insertion on T6–T7 intervertebral space. Hypercapnia was obtained by CO2 breathing. PaCO2 (partial pressure of CO2, arterial) was adjusted to 30, 45, and 60 mm Hg with each concentration being maintained for 10 minutes. In each period, hemodynamic variables were monitored by pulmonary artery catheter. After returning to normocarbia for 15 minutes, 20 mL of 0.375% ropivacaine was injected epidurally and PaCO2 was adjusted in the same manner, and then, the hemodynamic variables of each period were checked.
Results
There were no changes in mean arterial pressure and heart rate by hypercapnia after combined epidural anesthesia compared with general anesthesia only. Hypercapnia increased cardiac output and cardiac index. Systemic vascular resistance was decreased significantly. Pulmonary artery pressure was increased but not significantly. The degrees of hemodynamic changes were similar between in general anesthesia alone and in combined epidural anesthesia.
Conclusion
In spite of an extensive epidural block, hemodynamic changes induced by hypercarbnia were not changed. There are some ‘escaped’ sympathetic nerve fibers.
서 론
이산화탄소 자체는 심장근육과 혈관 모두에 직접적인 억제효과를 나타내지만, 고탄산혈증은 교감신경계를 자극하여 교감신경 말단과 부신수질에서 catecholamine을 분비시켜 그 결과 최종적인 효과는 전신동맥압 상승과 심박출량의 증가이며, 이러한 현상은 의식이 있는 경우에서뿐만 아니라 전신마취 시에도 비슷한 정도로 나타난다고 한다[1-5]. 그러나 이러한 심혈관계 변화의 양상은 척추마취나 경막외마취로 교감신경계를 차단하여 심장의 교감신경을 지배하는 T1–T5 범위의 척추분절이 차단되거나 부신피질의 교감신경을 지배하는 T6–L2 범위의 척추분절이 차단되는 경우 catecholamine 분비가 억제되므로 이러한 심혈관계 변화가 약화되거나 일어나지 않을 수 있다[6-9]. 또한 전신마취와 경막외마취를 동시에 하고 있을 때 고탄산혈증이 유발되면 또 다른 심혈관계 변화가 나타날 가능성이 있다. 고탄산혈증에 대한 이전 연구들은[1-10] 동물에 대한 실험이었거나 의식이 있는 경우에 시행되었거나 저산소혈증과 동반된 경우, 혈중 catecholamine 농도만 측정한 경우 또는 부분적인 척추분절이 차단된 상태에서의 연구들이었다.
이에 저자들은 전신마취하에 저산소혈증은 배제된 상태에서 1번 흉추에서 2번 요추까지 광범위한 범위의 경막외마취로 교감신경계를 차단하는 것이 고탄산혈증으로 인한 심혈관계에 미치는 양상을 어떻게 변화시키는지 알아보고자 본 연구를 계획하였다.
대상 및 방법
전신마취하에 췌십이지장절제술 혹은 간엽절제술을 시행 받는 미국마취과학회 신체등급 분류 1, 2에 해당하는 20명의 환자를 대상으로 하였다. 기왕력상 고혈압, 협심증, 심근경색, 부정맥 등의 심혈관계질환이 있거나 수술 중 500 mL 이상의 출혈이 있었던 환자는 대상에서 제외하였다. 순천향대학교 서울병원 임상연구윤리위원회의 승인하에 마취 전 환자를 방문하여 연구목적과 연구 중 발생 가능한 합병증을 환자에게 설명하고 서면동의서를 받았다. 환자의 나이, 신장, 체중은 Table 1과 같았고, 수술종류는 Table 2와 같았다.
마취 유도 30분 전 glycopyrrolate 0.2 mg 및 midazolam 2 mg을 근주로 마취 전 투약하고, 수술실 도착 후 비침습적 동맥압, 심전도, 심박수, 맥박산소포화도 등의 기본적인 검사를 하였다. 수술 후 통증조절을 위해 정중법으로 제6–7 흉추 간에 경막 외 카테터를 삽입하였다. 전신마취 유도로 lidocaine 0.7 mg/kg, propofol 2 mg/kg, rocuronium 1 mg/kg을 정주한 후 기관 내 삽관을 하였고, O2 (2 L/min), N2O (2 L/min), sevoflurane (1.5–2.5 vol%)으로 마취를 유지하였으며 근이완을 위해 rocuronium을 8 μg/kg/min의 속도로 지속 정주하였다. 기계환기로 동맥혈 이산화탄소 분압 30±3 mm Hg, 맥박산소포화도 98%–100%의 범위를 유지하였다.
전신마취 후 요골동맥을 천자하였고, 우측 내경정맥을 통해 8.5-French 유도관(SI-09880; Arrow International, Reading, PA, USA)을 통하여 7.5-French 폐동맥 카테터(AH-05050-H, Arrow International)를 삽입하였다. 수술 시작 1시간 후 혈역학적 변화가 안정된 것을 확인한 뒤 심박출량, 심박출계수, 평균 폐동맥압, 전신혈관저항 등을 측정하였다. 호흡회로를 통해 의료용 이산화탄소를 흡입시켜 동맥혈 이산화탄소 분압을 45±3 mm Hg로 10분간 유지한 후 다시 상기 수치를 측정한 후, 동맥혈 이산화탄소 분압 30±3 mm Hg로 10분을 유지하였고, 다시 동맥혈 이산화탄소 분압을 60±3 mm Hg으로 변화시킨 10분 후 폐동맥 카테터를 이용하여 심박출량, 심박출계수, 평균 폐동백압, 전신혈관저항 등을 측정, 기록하였다. 그 후 15분간 동맥혈 이산화탄소 분압을 30±3 mm Hg 상태로 안정한 후 경막 외 카테터를 통해 0.375% ropivacaine 20 mL를 주입하였다. 경막외마취 30분 후부터 동맥혈 이산화탄소 분압을 30±3 mm Hg, 45±3 mm Hg, 60±3 mm Hg으로 변화시키면서 앞에 기술한 방법과 동일하게 심박출량, 심박출계수, 평균 폐동맥압, 전신혈관저항 등을 측정, 기록하였다.
통계적 처리는 SPSS 프로그램 ver. 12.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 혈역학적 수치의 변화는 two-way repeated analysis of variance 검사로 시행하였으며, 전신마취하에 탄산과잉혈증만 유발했던 경우와 경막외마취를 병행한 경우에서의 혈역학 수치 변화 정도는 linear mixed model로 비교하였다. P값이 0.05 미만인 경우를 통계적으로 의미 있는 것으로 판정하였다.
결 과
대상 환자의 연령은 59.7±11.3세, 신장은 161.1±6.0 cm, 체중은 62.0±9.2 kg였다(Table 1). 시행 받은 수술의 종류는 Whipple’s operation 13예, liver lobectomy 3예, liver segmentectomy 2예, pancreatectomy 2예였다(Table 2).
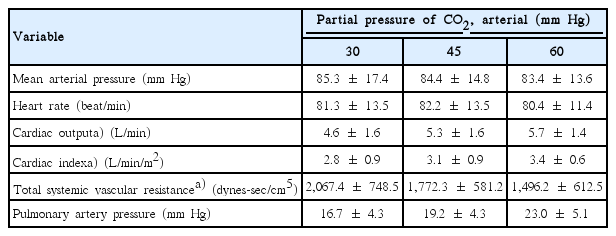
전신마취 후 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 평균 혈압 및 심박수는 85.3±17.4, 84.4±14.8, 83.4±13.6 mm Hg 및 81.3±13.5, 82.2±13.5, 80.4±11.4회/분으로 의미있는 변화를 보이지 않았다. 심박출량 및 심박출계수는 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 4.6±1.6, 5.3±1.6, 5.7±1.4 L/min 및 2.8±0.9, 3.1±0.9, 3.4±0.6 L/min/m2로 의미 있는 증가를 보였다. 평균 폐동맥압은 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 16.7±4.3, 19.2±4.3, 23.0±5.1 mm Hg로 증가하였으나 통계적 의미는 없었다. 전신혈관저항은 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 2,067.4±748.5, 1,772.3±581.2, 1,496.2±612.5 dynes-sec/cm5로 통계적으로 의미 있게 감소하였다(Table 3).
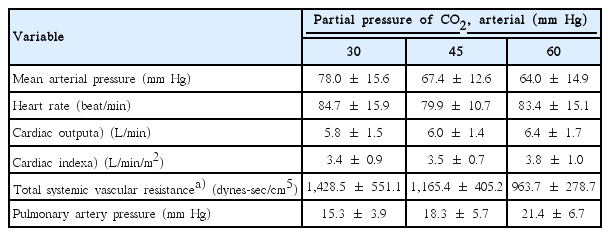
제6–7 흉추 간에 경막 외 카테터로 0.375% ropivacaine을 투여하고 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 평균 혈압 및 심박수는 78.0±15.6, 67.4±12.6, 64.0±14.9 mm Hg 및 84.7±15.9, 79.9±10.7, 83.4±15.1회/분으로 의미 있는 변화를 보이지 않았다. 심박출량 및 심박출계수는 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 5.8±1.5, 6.0±1.4, 6.4±1.7 L/min 및 3.4±0.9, 3.5±0.7, 3.8±1.0 L/min/m2로 의미 있는 증가를 보였다. 평균 폐동맥압은 동맥혈 이산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 15.3±3.9, 18.3±5.7, 21.4±6.7 mm Hg로 증가하였으나 통계적 의미는 없었다. 전신혈관저항은 동맥혈이 산화탄소 분압을 30, 45, 60 mm Hg로 변화시켰을 때 1,428.5±551.1, 1,165.4±405.2, 963.7±278.7 dynes-sec/cm5로 통계적으로 의미 있게 감소하였다(Table 4).
흉추 경막외마취 전과 시행한 후의 심박출계수와 전신혈관저항 변화의 정도는 linear mixed model로 검사한 결과 차이가 없었다(Figs. 1, 2).

Cardiac index increased significantly during thoracic epidural anestheisia (P< 0.01). The degrees of increase, that is, the slope of graph of the trend of cardiac index did not changed during thoracic epidural anesthesia compared with general anesthesia alone (P= 0.314).
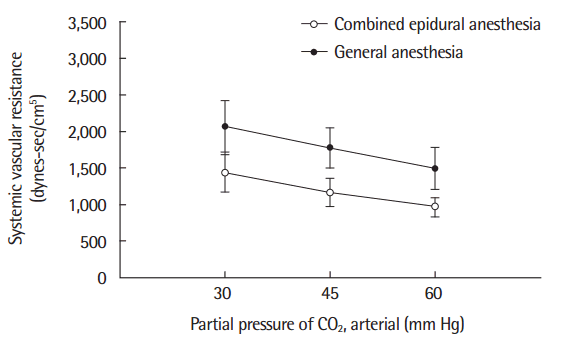
Systemic vascular resistance decreased during thoracic epidural anesthesia (P< 0.01). Degrees of change, that is, slope of graph of the trend of systemic vascular resistance by increasing hypercapnia did not changed during thoracic epidural anesthesia compared with general anesthesia alone (P= 0.314).
고 찰
저자들은 본 연구에서 전신마취 중 흉추 6–7번 사이 경막외강으로 0.375% ropivacaine 20 mL를 투여하여 T1부터 L2까지 광범위한 범위의 교감신경계를 차단하는 것이 고탄산혈증으로 인한 심혈관계에 미치는 양상을 어떻게 변화시키는지 알아본 결과 교감신경계를 완전히 차단할 수 없다는 것을 알 수 있었다.
고탄산혈증이 인체의 심혈관계에 미치는 영향은 저산소혈증만큼이나 복잡하다. 이산화탄소 자체는 심장근육과 혈관 모두에 직접적인 억제효과를 갖지만, 동시에 교감-부신계에 반사적인 자극을 야기하여 일차적인 심혈관계 억제작용을 크거나 작은 범위에서 보상하여 결과적으로 혈압과 심박출량이 증가하게 된다[1-5]. 고탄산혈증이 유발할 때 교감신경을 통한 부신계의 활성화는 6번 흉추에서부터 2번 요추의 척추분절에 지배를 받으며, 그 결과 부신수질에서 epinephrine이 분비된다. 또한 고탄산혈증 유발 시에는 1번 흉추에서부터 2번 요추의 척수신경에서 기원한 교감신경의 신경절 이전 섬유의 활성화에 의해서 norepinephrine이 교감신경의 말단에서 혈장으로 분비된다[11,12]. 인체에서 고탄산혈증은 교감신경계에 이러한 현상을 유발하여 혈역학적 변화를 유발하지만 1–5번 흉추 척추분절이 지배하는 심장의 chronotropic 및 inotropic 조절 또한 혈역학의 변화에 영향을 미친다. 그 결과 인체에서 고탄산혈증은 수축기 동맥압, 이완기 동맥압 및 평균 동맥압을 상승시키며, 심박출량, 심박출지수, 폐동맥압 및 심근의 산소요구량을 증가시키고 전신혈관저항은 감소시킨다[1-5]. 이러한 현상은 저산소혈증이 유발할 때에도 나타난다.
저산소혈증이 심혈관계에 미치는 영향은 neural reflex (aortic and carotid chemoreceptor, baroreceptor, and central cerebral stimulation)와 humoral reflex (catecholamine and renin-angiotensin release) 및 direct effect (inhibitory and vasodilatory effect)에 인한 것들이 복합되어 나타나는데, 이는 저산소증의 정도에 따라 다양하게 반응한다. 그 결과 산소분압 80 mm Hg 정도의 경한 저산소혈증의 경우에는 catecholamine 분비가 촉진되어 심박수, 일회 심박출량 및 심박출량이 증가된다[1,6,13-15]. 더욱이 Stevens 등[6]은 개에게 sufentanil을 투여하여 저환기를 유발하고 이로 인해 저산소혈증 및 고탄산혈증이 발생되었을 때 plasma epinephrine은 기준치 279±80에서 2,010±1,416 pg/mL로 norepinephrine은 108±73에서 843±399 pg/mL로 증가하였으며, 평균 혈압도 증가하였다고 보고하였다. 또한 이들은 2% lidocaine으로 1번 흉추에서 6번 요추까지 경막외마취를 한 후 동일한 실험을 하여 plasma epinephrine 및 norepinephrine은 기준치에 비해 50% 감소하였다고 하였다. 따라서 개에서 고위 경막외마취는 저환기로 인한 catecholamine 분비 촉진현상을 약화시키지만, 기준치 값의 50% 정도의 혈중 농도는 유지되는 것으로 보아 고위 경막외마취로 완전한 efferent sympathetic block은 일어나지 않았다고 보고하였다. 그러나 이들의 연구는 저환기를 이용하여 저산소혈증 및 고탄산혈증을 유발하였으므로 고탄산혈증 단독으로 인한 변화의 양상을 본 것이 아니었고 더욱이 저환기로 인한 혈역학적 변화는 고려되지 않은 결과였다.
고탄산혈증이 인체에 미치는 영향에 대한 연구로[1-5], Mas 등[3]은 흡입마취제를 사용하지 않고 인공환기를 받는 환자를 대상으로 동맥혈 이산화탄소 분압을 40에서 52 mm Hg로 증가시켰을 때 심박수가 95에서 105회/분으로, 심박출계수는 3.43에서 3.97 L/min/m2로 평균 폐동맥압은 21에서 24 mm Hg로 증가하였고, 전신혈관저항은 992에서 813 dynes-sec/cm5로 감소하였다고 하였다.
이러한 인체의 고탄산혈증 유발 시 혈역학의 변화가 전신 흡입마취로 인해 변화하는지에 대한 연구로 Wattwil과 Olsson [4]은 고탄산혈증이 평균 동맥압, 심박출량, 폐동맥압, 중심정맥압, 폐동맥쐐기압 및 폐혈관저항 등을 상승시켰으나 전신혈관저항은 변화가 없었다고 보고하였고, 고탄산혈증이 유발된 상태에서 3% isoflurane을 흡입한 결과 전신동맥압 및 전신혈관저항은 즉시 감소하였으나 심박출량, 일회박출량, 폐동맥압 등은 변화가 없었다고 보고하였다. 또한 Ok 등[5]은 이번 연구에서와 같이 sevoflurane으로 전신마취를 하고 저환기로 고탄산혈증을 유발한 후 심혈관계의 변화를 관찰하여 호기말 이산화탄소 분압을 30, 40, 50 mm Hg로 변화시켰을 때 평균 혈압 및 심박수는 의미 있는 변화를 보이지 않았고, 심박출량 및 심박출계수는 4.9±1.7, 5.5±1.7, 6.2±2.1 L/min 및 3.0±0.9, 3.4±0.9, 3.8±1.1 L/min/m2로 의미 있는 증가를 보였으며, 평균 폐동맥압 또한 16.9±3.7, 19.6±4.2, 23.0±4.7 mm Hg로 의미 있는 증가를 보였으나, 전신혈관저항은 1,558.3±500.4, 1,423.5±678.6, 1,156.8±374.0 dynes-sec/cm5로 감소를 보였으나 의미 있는 것은 아니라고 보고하면서 이는 isoflurane에 비해 심박출량은 비슷한 정도로 상승하였으나, 전신혈관저항은 isoflurane에 비해 현저히 감소한 것이었다고 보고하였다.
경막외마취는 인체에서 catecholamine의 분비를 억제하여[6,7] 이로 인해 심혈관계에 영향을 미칠 수 있다. 이에 대한 연구로 Stevens 등[7]은 젊은 자원자를 대상으로 경막외마취의 범위에 따른 혈중 epinephrine과 norepinephrine 농도의 변화를 관찰하여 epinephrine은 7번 경추 부위까지 차단이 되어도 현저하게 감소하지 않았고, norepinephrine은 7번 흉추까지는 변화가 없었으나 7번 경추까지 차단된 경우에만 통계적으로 의미 있게 감소하였다고 하였다.
경막외마취가 저산소혈증이 심혈관계에 미치는 영향을 어떻게 변화시키는지에 대한 보고로 Peters 등[8]은 의식이 있는 개에게 흡입 산소농도를 감소시켜 저산소혈증을 유발한 경우 평균 동맥압과 심박수가 증가하였으나, 경막외마취가 동반되는 경우에는 혈압 상승은 없었고 심박수만 약간 증가되었고 따라서 저산소혈증으로 인한 심혈관계의 반응은 경막외마취로 약화된다고 하였다.
또한 고탄산혈증이 심혈관계에 미치는 영향을 경막외마취가 어떻게 변화시키는지에 대한 보고로 Sundberg와 Wattwil [9]은 노인 15명을 대상으로 3–4번 흉추 사이의 경막 외 카테터로 0.5% bupivacaine 5–6 mL를 주입하여 심장의 chronotropic and inotropic control을 담당하는 1에서 5번 흉추 사이의 교감신경을 차단하고 고탄산혈증을 유발시키면서 혈역학적 변화의 양상을 관찰한 결과 고탄산혈증의 경우 심박수, 평균 동맥압, 심박출량, 폐동맥쐐기압의 증가가 있었고, 이러한 현상은 경막외마취로 1–5번 흉추 교감신경을 차단해도 변하지 않았으며, epinephrine과 norepinephrine은 고탄산혈증의 경우 의미 있게 증가하였으나, 고탄산혈증과 경막외 마취를 병용하는 경우에는 약간만 증가하였다고 하였다.
저자들은 본 연구에서 sevoflurane 마취하에 저산소혈증은 배제된 상태에서 1번 흉추에서 2번 요추까지 광범위한 범위의 경막외마취로 교감신경계를 차단하는 것이 고탄산혈증이 심혈관계에 미치는 양상을 어떻게 변화시키는지 알아보고자 본 연구를 계획하였고, 그 결과 경막외마취와 상관없이 고탄산혈증 유발 시 평균 혈압 및 심박수는 변화하지 않았고, 심박출량 및 심박출계수는 의미 있게 증가하였으며, 전신혈관저항은 감소하였고, 통계적 의미는 없었으나 평균 폐동맥압은 증가하였다. 이러한 혈역학 수치의 변화 정도 역시 고탄산혈증 단독의 경우나 경막외마취를 병행한 경우 차이가 없었다.
본 연구에서 경막외마취 후에도 폐동맥압이 증가한 것은 고탄산혈증으로 인한 호흡성 산증 시 폐혈관저항과 폐관류압, 폐동맥압이 증가했다는 Malik과 Kidd [16]의 연구와도 일치하였고 그들이 언급하였던 폐혈관은 교감신경에 독립적으로 작용한다는 보고와도 일치되는 결과였다.
또한 저자들의 결과는 이전 보고 중 본 연구와 가장 유사하게 시행되었던 Sundberg와 Wattwil [9]의 결과와 일치하는 것이었으나 그들은 전신마취를 시행하지 않았었고, 경막외마취 후 호흡저하에 따른 저산소증의 가능성 또한 언급하지 않았으며, 1–5번 흉추 범위까지만 경막외마취를 하여 고탄산혈증 유발 시 6번 흉추에서부터 2번 요추의 척추분절에 지배를 받는 교감신경을 통한 부신계의 활성화로 인한 epinephrine의 분비 및 1번 흉추에서부터 2번 요추의 척수신경에서 기원한 교감신경의 신경절 이전 섬유의 활성화에 의해서 교감신경의 말단에서 분비되는 norepinephrine의 영향은 배제되지 않은 결과였다. 또한 본 연구에서와는 달리 전신혈관저항의 변화가 없었던 바 이는 경막외마취 범위가 본 연구보다 훨씬 좁았기 때문이다.
본 연구에서 6–7번 흉추 사이 경막외강으로 투여한 0.375% ropivacaine 20 mL로 고탄산혈증으로 인해 유발되는 교감신경 자극을 억제하지 못했던 원인으로 경막외마취는 척추마취에 비해 감각 및 운동신경섬유를 완전히 차단시키지 못하고 경막외마취 시에는 교감신경계가 불완전하게 차단되는 ‘escaped’ sympathetic nerve fibres가 존재한다는 Bromage [17]의 보고로 설명할 수 있다.
본 연구의 제한점으로 경막외마취로 6–7번 흉추 사이 경막외강으로 투여한 0.375% ropivacaine 20 mL로 교감신경계를 완전히 차단할 수 있는 범위인 1번 흉추에서 2번 요추까지 차단이 되었을까 하는 의문으로, 본 연구에서는 전신마취하에 경막외마취를 병용하여 임상적으로는 차단의 범위를 판별할 수 없었으나 경, 흉추 경막외마취 시 마취범위에 대한 보고로 Wittich 등[18]은 척수일절 부위를 차단시키는 데 국소마취제 1.22 mL가 요구된다 하였고, Gil 등[19]은 1.6 mL, Ryoo 등[20]은 1.45 mL가 필요하였다는 보고를 볼 때 본 연구에서 1번 흉추에서 2번 요추 사이가 대부분 차단되었을 것이라고 생각된다.
또 다른 제한점으로 Serebrovskaya [13]의 보고에서와 같이 60 mm Hg 이상의 고탄산혈증을 유발하면 급격한 심혈관계 변화가 나타날 가능성이 있고, Feihl와 Perret [21]도 동맥혈 이산화탄소 분압 80 mm Hg 이하, pH 7.15까지는 인체에 해롭지 않다고 보고는 하였지만 임상연구의 한계로 60 mm Hg 이상의 고탄산혈증을 유발한 후 실험을 진행하지는 못하였다. 또한 고농도의 ropivacaine을 사용하면 교감신경계가 좀 더 완벽하게 차단되어 또 다른 결과가 나왔을 수도 있으나 이 경우 급격한 혈역학적 변화가 예상되어 실험을 진행하지 못하였다.
저자들은 본 연구에서 사람에게 전신마취 중 경막외마취로 1번 흉추에서부터 2번 요추까지 광범위한 범위의 교감신경계를 차단하는 것이 고탄산혈증으로 인한 교감신경계 자극으로 유발되는 심혈관계 반응을 어떻게 변화시키는지 알아본 결과 6–7 흉추 간에서 투여한 0.375% ropivacaine 20 mL로는 교감신경계를 완전히 차단할 수 없었고 따라서 심혈관계 반응도 변화하지 않았다는 것을 알 수 있었다.