극심한 급성빈혈에 의한 사망 증례와 단독 사망 예측인자:혈색소 농도 2 g/dL
Death below 2 g/dL of Hemoglobin Concentrations: As an Independent Predictor of Death
Article information
Trans Abstract
Fifty three years old, healthy female patient had presented an acute severe anemia after intestinal bleeding within 2 days. She was hemodynamically stable even during extreme hemodilution with hemoglobin (Hb) below 3 g/dL. However, her condition deteriorated dramatically after Hb nearly 2 g/dL. The patient died solely of anemia at a hemoglobin concentration of 1.2 g/dL. We presumed the hemoglobin concentrations below 2 g/dL are maximally life-threatening; this is the terminal hemoglobin threshold that the hemoglobin concentration could be an independent predictor of death.
서 론
수혈을 할 수 없는 빈혈 환자에서는 순환 혈액량이 충분하도록 수액을 공급하며, 심박출량을 증가시켜서 빈혈로 인한 산소공급감소를 보상할 수 있도록 한다. 그러나 이러한 보상작용만으로 산소공급과 소모의 균형을 맞출 수 없는 임계점이 존재할 것이며, 다각적인 노력에도 불구하고 생명을 유지할 수 없는 빈혈의 한계점이 존재할 것이다. 산소공급과 소모의 불균형이 발생하는 혈색소의 임계점은 3-5 g/dL 이하일 것이라고 추측되고 있다[1-3]. 그러나 빈혈의 정도만으로 사망을 예측하는 것은 어려운 일이어서[4-6] 사망이 예측되는 혈색소 한계점은 아직 알지 못한다.
혈색소 함계점을 찾는 임상실험은 불가하겠지만 극심한 빈혈로 인해 사망에 이른 여러 증례들을 바탕으로 이 한계점을 추정해 볼 수 있고, 이를 바탕으로 사망위험도 판정에 도움을 줄 수 있을 것이다. 본 증례에서는 기저질환 없는 건강한 환자가 장출혈 후 급성으로 발생한 극심한 빈혈이 원인이 되어 사망하였다. 저자들은 이를 보고하여 생명유지를 위한 혈색소 한계점에 대해 고찰해 보고자 한다.
증 례
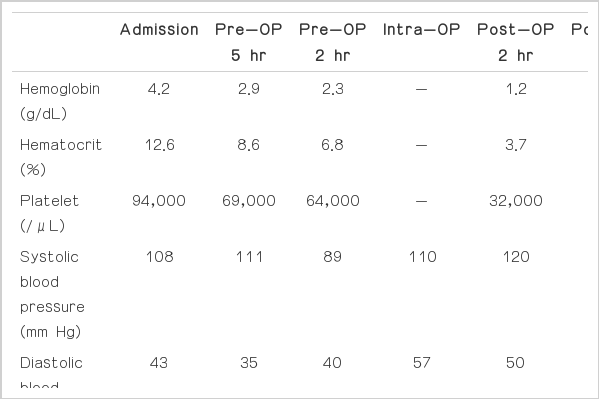
체중 51 kg, 키 160 cm, 53세의 여자 환자가 혈변을 주소로 내원하였다. 환자에게 기저질환 및 특이 과거력이 전혀 없었으며 내원 전일상생활에 불편사항 없었다. 환자는 내원 이틀 전 오전 8시경 흑변을 보아 이전 병원에서 위내시경을 시행하였으나 출혈 부위를 발견하지 못하고, 대장내시경 시행을 계획하고 있었다. 그러나 관장 도중 3차례에 걸쳐 약 1 L 가량의 혈변을 보았고, 수축기혈압 90 mm Hg, 심박수 100회/분 정도로 유지되어 중심정맥관과 응급수혈 및 내시경적 지혈술을 권고 받았다. 환자는 종교적 이유로 수혈을 거부하여 수혈을 배제한 치료를 위해 순천향대학교 서울병원으로 전원되었다. 전원되기 전 측정한 혈색소 수치는 6.6 g/dL였고, 내원 당시 혈압은 108/43 mm Hg, 심박수 104회/분, 호흡수는 분당 16회, 맥박산소포화도는 100%였다. 내원 당일 내시경으로 많은 양의 혈액을 대장 내에서 발견하였으나 출혈 부위는 발견할 수 없었고, 조영제를 사용한 복부컴퓨터단층촬영을 시행한 결과 공장에 조영제가 유출되는 소견이 관찰되었다. 검사하는 동안 비강 캐뉼라로 산소를 지속 공급하였고, 검사 전후로 중심정맥관을 통해 생리식염수 1,600 mL가 주입되었으며, 소변량은 350 mL로 확인되었다. 출혈 부위 확인 및 색전술 시행을 위해 동맥촬영술을 시행하였으나 출혈부위가 확인되지 않아 동맥출혈이 아닌 것으로 결론지었다. 그러나 내원 당시 혈색소 수치가 4.2 g/dL, 적혈구 용적률이 12.6%로 측정되었는데, 검사 후 혈색소 수치 2.9 g/dL, 적혈구 용적률 8.6%로 감소하고 내원 5시간 만에 혈색소 수치가 2.3 g/dL, 적혈구 용적률 6.8%로 측정되어 응급 장절제술 시행이 결정되었다(Table 1).
수술 전 시행한 혈액검사상 혈청 알부민 2.4 g/dL, 혈당 233 mg/dL로 측정된 것 외에 특이소견은 없었고, Creatine kinase MB isoenzyme 1.30 ng/mL, Troponin-T 0.014 ng/mL, lactate dehydrogenase 88 U/L, 혈소판 수치 64,000/μL, 혈액응고검사에서 prothrombin time (PT) 13.2초, international normalized ratio (INR) 1.15, activated partial thromboplastin time (aPTT) 24.1초, fibrinogen 127 mg/dL였다. 수술실 입실 직전 혈압은 90/40 mm Hg, 심박수 120회/분, 호흡수 18회/분이었으며, norepinephrine을 지속 정주용으로 준비한 상태로 입실하였다. 입실 시 환자는 피부가 창백하고 의식이 혼돈상태였으며 혈압은 110/57 mm Hg, 심박수 125회/분, 호흡수 18회/분, 맥박산소포화도는 99%였다. 마취 유도를 위해 etomidate 5 mg을 주입하고 근이완제로 rocuronium 50 mg을 주입하였다. 기관 내 삽관을 시행하고 일회 호흡량 400 mL, 분당 10회로 인공 환기하면서 desflurane 4 vol%로 마취 유지하고 산소는 100%로 투여하였다. 좌측 요골동맥에 카테터를 거치하여 침습적 동맥혈압을 지속적으로 측정하고 동맥압 파형을 이용한 지속적 심박출량 감시기(VigileoTM; Edwards Life science, irvine, CA, USA)를 이용하여 심계수(cardiac index)와 심박출량 변화(stroke volume variation)를 관찰하면서 수술을 진행시켰다. 출혈량을 감소시키고자 수술 시작 전 tranexamic acid 500 mg을 20분 동안 정주하고, 이후 50 mg/hr로 지속 정주하였다. 수술 시작 후 혈압은 100/45-130/60 mm Hg, 중심정맥압 6-10 mm Hg, 심박수 99-110회/분로 유지되었다. 수술 중 entropy는 response entropy, state entropy 수치 모두 40-50으로 유지되었고, 맥박산소포화도 99%, 호기말 이산화탄소 분압 25-29 mm Hg, 체온 36.3°C로 유지하였다. Entropy 수치로 보아 마취 심도는 적절히 유지되고 있었으나 수술적 조작에 반응하여 혈압이 상승하는 소견을 보여 remifentanil 정주를 시작하였고, 혈압 변동에 맞추어 조심스럽게 조절하여 효과처 농도 4-5 μg/mL로 혈압은 95/43-130/60 mm Hg, 심박수 100-110회/분으로 유지하였고, 이때 심계수는 4.2-4.5 L/min/m2, 심박출량 변이도는 6-8%였다. 수술 시작 1시간 후 혈압이 88/54 mm Hg로 하강하여 phenylephrine 30 μg 1회 주입되었으나, 이후 혈압 105/50-125/55 mm Hg, 심박수 95-110회/분으로 안정적으로 유지되어 추가적인 투약은 필요하지 않았다. 심전도 파형은 수술 전 기간 동안 정상소견을 보였다. 수술 시작 2시간 후 시행한 동맥혈 가스분석검사에서 pH 7.423, pO2 477 mm Hg, pCO2 28.8 mm Hg, HCO3 18.4 mmol/L, base excess -4.5, SaO2 99.9%였다. 공장에 출혈부위를 확인하여 부분 절제술이 시행되었고, 수술 중 출혈량은 약 50 mL, 주입된 수액은 교질액(Volulyte) 1,600 mL, 소변량 300 mL, 총 수술시간은 2시간 25분이었다. 자가수혈이 준비되어 있었으나 출혈이 적어 재주입된 혈액은 없었다.
수술 종료 후 desflurane 투여를 중단하고 midazolam 1 mg을 투약한 후 삽관상태로 중환자실로 환자를 이송하였고, 중환자실 입실 시 환자의 혈압은 160/80 mm Hg, 심박수 120회/분, 중심정맥압 14 mm Hg로 측정되고 심전도는 정상이었다. 중환자실에서 midazolam 정주로 혼수상태를 유지하고 인공 환기를 지속하였고, lasix 10 mg 정주, Vit-K 40 mg 정주, 수산화제이철수크로오스복염(Venoferrum) 1,000 mg 1시간 동안 정주, darbepoetin alpha 120 μg (novel erythropoiesis stimulating protein) 피하 주사하였다. 혈압 120/55-130/60 mm Hg 유지되다가 중환자실 입실 1시간 후 수축기 혈압 100 mm Hg 미만이 되어 dopamine 정주를 시작하여 1시간 동안 10 μg/kg/min까지 증량하였다. 혈액검사상 혈색소 수치 1.2 g/dL, 적혈구 용적률 3.7%로 감소하고 알부민 1.0 g/dL, 혈당 220 mg/dL, 혈소판 수치 32,000/μL, 혈액응고검사에서 PT 320초 초과, 5% 미만, INR 24, aPTT 400초였다. 동맥혈 가스분석검사결과 pH 7.4, pO2 330.8 mm Hg, pCO2 25.2 mm Hg, HCO3 19.0 mmol/L, BE -3, SaO2 99.8%였고, 음이온 차이는(anion gap, AG) 23.6 mEq/L, 교정음이온 차이(corrected AG) 33.35 mEq/L였다[7]. 중환자실 입실 5시간 후 혈압 60/41 mm Hg로 하강하여 이후 지속적으로 norepinephrine 0.1-0.5 μg/kg/min 정주하였다. 그러나 저혈압상태가 지속되다가 중환자실 입실 7시간 후 혈압 30/11 mm Hg로 측정되어 epinephrine 1 mg 정주하고 70/45-80/50 mm Hg으로 상승시켰으나, 다시 서서히 하강하여 중환자실 입실 10시간 후 심정지상태가 되었다. 10시간 동안 주입된 수액은 5% 알부민 1,000 mL, 생리 식염수 2,200 mL, volulyte 500 mL였고, 소변량 1,510 mL, hemobag으로 출혈량은 50 mL였다. 사전 합의대로 심폐소생술 시행 없이 환자는 사망하였다.
고 찰
본 증례에서 기저질환 없이 건강했던 환자가 장출혈로 인해 급속도로 심각한 빈혈상태가 되었다. 환자의 의식은 혼돈상태였으나 혈색소 수치 2-3 g/dL에 이르기까지 혈역학적으로 안정적이었으며, 전신마취와 수술 후에도 심근허혈 등의 증후는 보이지 않았다. 그러나 혈색소 수치 1.2 g/dL로 감소하면서 급격히 상태가 악화되어 수술 후 10시간 만에 사망에 이르렀다.
이 증례에서와 같이 혈색소가 2 g/dL 이하일 때 심각한 빈혈만을 원인으로 사망에 이른 보고들을 찾아볼 수 있다. Carson 등[8]이 1994년까지 13년 동안의 후향적 코호트연구에서 혈색소 수치 감소에 따른 사망률 증가 양상을 확인하였는데, 특히 2.1-3.0 g/dL이었던 환자에서의 30일 사망률은 54.2%였고, 혈색소 1.1-2.0 g/dL이었던 환자 7명의 사망률은 100%, 이 중 5명은 심혈관계질환이 없는 환자였다. 또한 MacLaren과 Anderson [9]이 1999년부터 2003년까지 중환자실에서 치료받은 여호와의 증인 환자 21명을 대상으로 한 연구에서 생존한 환자 중 최하 혈색소 수치는 2.3 g/dL였고, 다른 질환 없이 빈혈만으로 사망한 환자의 혈색소 수치는 1.7 g/dL였다. 본 증례에서도 기저질환 없고 고령이 아닌 건강한 환자가 심한 빈혈만으로 사망하였고, 혈색소 수치가 2 g/dL 이하로 떨어지면서 급격히 사망에 이른 점이 혈색소 2 g/dL 이하에서는 생존이 매우 힘들 것이라는 MacLaren과 Anderson의 추론을 지지하게 한다.
혈색소 2 g/dL 이하에서 생존한 증례를 보면, 1991년 Brimacombe 등[10]이 혈색소 수치 1.4 g/dL까지 감소한 환자가 수혈 없이 생존하였다고 발표하였는데, 이 환자는 37세의 건강한 산모로 제왕절개 수술 후 24시간에 1.4 g/dL에 이르렀다. 이 환자는 산모였기 때문에 혈장량이 증가하는 생리적 차이로 혈색소 수치가 상대적으로 낮게 측정되었을 가능성이 있다. 1987년 Howell과 Bamber [11]는 혈색소 수치 1.8 g/dL까지 감소했던 증례를 발표하였는데, 이 환자는 5일에 걸쳐 최하 혈색소까지 이른 것으로 감소 속도가 비교적 느렸던 것이 생존요인이 되었을 것이라 추측할 수 있다. Zollinger 등[12]이 1.1 g/dL에서 생존한 환자를 보고한 바 있으나 이 환자는 30분 후 수혈을 받아 생존하였다. 이 외 증례나 후향적, 전향적 연구들에서 수혈이나 인공혈액 대체제제 투여 없이 혈색소 2 g/dL 이하까지 감소한 급성빈혈 환자를 회복시킨 증례는 찾아보기 힘들다[1,8,9,13].
수혈에 따른 다양한 부작용과 예후에 악영향을 미친다는 여러 연구결과들에 따라 근래에는 수혈의 기준을 재정립하고 수혈을 줄이거나 대체할 수 있는 치료들에 대한 연구가 활발히 진행되고 있다. 그러므로 산소공급과 소모의 불균형이 발생하는 혈색소의 임계점에 대한 관심 또한 높아지고 있다. 이 임계점은 명확하게 연구되지 않았고, 환자와 그 상태에 따라 다를 것이나, 건강한 사람에서 조직의 산소 불균형상태를 유발하고 심혈관 허탈을 유발하는 혈색소 농도는 3-5 g/dL 이하일 것이라고 추측되고 있다[1-3]. 여러 연구에서 이때 사망률이 급격히 증가한다는 것이 밝혀졌지만[4,8], 위험도 판정방법들에서는 빈혈 정도가 사망의 독자적인 예측인자가 되지는 못한다고 하였다[4-6]. 그러나 본 증례와 같이 건강한 환자에서 심박출량이 유지되는 상황에서도 다른 문제 없이 급성의 극심한 빈혈에 의해 사망에 이른 보고들은 혈색소 농도 2 g/dL 이하는 독자적인 사망위험인자임을 밝혀주는 자료가 되어 줄 수 있다. 또한, 환자가 1일 이내 사망하여 Tobian 등[4]의 연구에서 최하 혈색소 농도가 2.0 g/dL 이하일 때 사망까지 걸린 시간이 0.5-1.5일, 중간값 1일이었다는 보고와 일치하는 결과를 보이므로 사망시기 예측가능성도 시사한다. 이렇게 혈색소 농도로 조기 사망위험도를 판정할 수 있다면, 제한된 의료자원의 적절한 분배와 치료전략 결정 등에 도움을 줄 수 있고, 수혈기준 정립에도 중요한 참고자료가 되어 줄 수 있을 것이다.
수혈을 거부하는 환자에 있어서 출혈을 최소화하기 위한 방안을 모색하고, 적혈구 생성을 증강시킬 수 있는 처방과, 혈관 내 용적을 유지하면서 산소공급을 최적화하기 위한 다방면의 접근과 노력이 필요하다. 본 증례에서도 지속적으로 산소를 공급하고 수술 전후로 흡입 산소분율을 높게 유지하여 산소공급량을 적정화하기 위해 노력했다. 또한 빈혈이 심하여 산소공급이 부족할 수밖에 없다면 산소소모량을 줄여주어야 하므로 수면상태를 유지하면서 근이완제를 사용하고 인공 환기를 유지하였다. 환자의 적혈구 생성을 촉진하기 위해 철분제제와 함께 darbepoetin alpha를 투여하였으나 혈색소 수치 증가의 효과를 보기 위해서는 최소 5일[14], 최대 효과를 보기 위해서는 6일이 필요한데[15], 환자가 1일 이내 사망하여 이러한 치료의 효과는 보지 못하였다.
보고된 다른 연구결과들과[8,9] 본 증례에서와 같은 결과를 보이는 더 많은 자료들이 뒷받침된다면 다른 위험인자들과 상관없이 2g/dL 이하의 혈색소 농도는 사망률 100%에 가까운 위험도를 갖는 것으로 볼 수 있을 것이다. 따라서 이러한 증례보고가 생존에 대한 혈색소 한계점 판단에 도움이 될 것이라 생각한다.