허혈성 심질환 환자에서 경요골동맥과 경대퇴동맥 경피적 관상동맥중재술 간의 효능과 안전 비교
Comparison of the Efficacy and Safety between Transradial and Transfemoral Percutaneous Coronary Intervention in Patients with Ischemic Heart Disease
Article information
Trans Abstract
Objective:
The incidence of colorectal carcinomas continues to rise in Korea due to the westernized life style. However, the precise colorectal carcinogenic mechanisms remain to be elucidated. The protein products of oncogenes and cancer suppressor genes play important roles in the carcinogenesis. The effects of the proteins are influenced by post-translational modifications as phosphorylation, acetylation, methylation, and ubiquitination. The aberrant sumoylation plays some roles in carcinogenesis. However, the expression pattern of small ubiquitin-related modifier (SUMO)-2/3 in the colorectal cancer has not been reported. We assessed the expression of SUMO-2/3 and evaluated the expression pattern in colorectal cancer.
Methods:
The SUMO-2/3 expression was tested in one normal colon mucosal cell line and 5 colorectal cancer cell lines by Western blot. We collected 322 cases of colorectal cancer operated from January 2000 to December 2010 at Soonchunhyang University Cheonan Hospital. We fabricated the tissue microarray and the expression of SUMO-2/3 was evaluated by immunohistochemistry. The results were analyzed with clinicopathologic parameters.
Results:
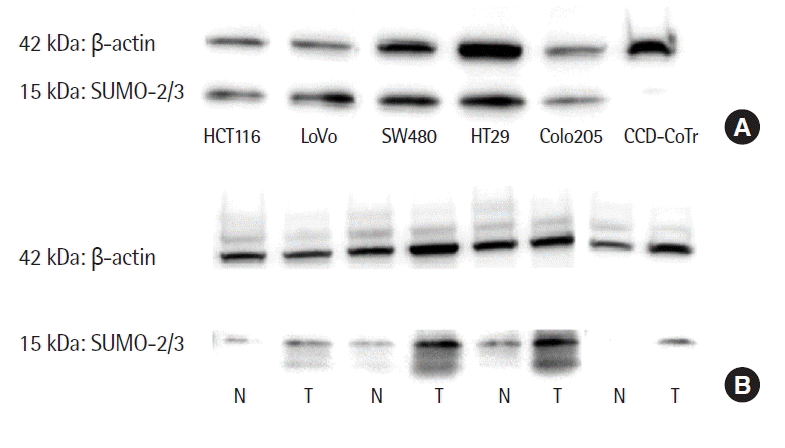
The SUMO-2/3 was not expressed in the normal colon mucosal cell line. However, it was expressed highly in all the 5 colorectal cancer cell lines as the beta-actin. The SUMO-2/3 was expressed in 68.3% of the colorectal cancers and its expression was correlated with the pathological tumor stage stage (odds ratio, 2.89; 95% confidence interval, 1.10 to 7.55; P= 0.031).
Conclusion:
The SUMO-2/3 plays some roles in carcinogenesis and progression of the colorectal cancer.
서 론
대장암은 우리나라에서 식생활습관이 서구화됨에 따라 증가되는 경향을 보이는 악성종양으로 아직 이의 명확한 발생기전이 밝혀지지 않고 있는 실정이다. 따라서 이에 대한 다각적인 연구가 필요하다. 암발생에 있어서 암유전자 산물과 암억제유전자 산물의 평형이 중요한 역할을 한다. 이들 유전자 산물인 단백의 기능은 다양한 전사 후 수정(post-transcriptional modification)에 의하여 그 기능이 조절된다. 단백질의 전사 후 수정은 인산화(phosphorylation), 아세틸화(acetylation), 메틸화(methylation) 및 유비퀴틴화(ubiquitination) 등 다양한 형태로 이루어지며 이러한 수정에 의하여 단백질 기능의 다양성을 나타낸다. 이들 중 유비퀴틴화는 단백질의 분해에 매우 중요한 역할을 하고 있다[1]. Small ubiquitin-related modifier (SUMO)의 아미노산 서열은 유비퀴틴과 비교할 때 18%만이 동일하나 3차구조적 분자모양은 유비퀴틴과 매우 유사하여 다른 단백과 유비퀴틴화와 유사한 기전으로 결합하여 전사 후 수정을 한다. 포유동물에서의 SUMO는 SUMO-1, -2, -3 및 -4의 4종이 알려졌다. 이 중 SUMO-1은 SUMO-2 및 -3과 아미노산 서열이 46%에서 같은 반면 SUMO-2와 -3은 96%의 아미노산 서열이 같고 기능도 유사하기 때문에 SUMO-2와 -3을 SUMO-2/3로 기술하기도 한다[2,3]. 정상적인 세포가 다양한 종류의 stress를 받게 되면 DNA의 불안정화로 암화(carcinogenesis)가 쉽게 일어난다. 이러한 암화과정에 여러 단백질들의 SUMO-2/3 SUMO화(sumoylation)가 일어나기 때문에 SUMO-2/3 단백 증가는 암발생을 예측할 수 있다. 그러나 지금까지 대장암에서의 SUMO-2/3 단백 발현 변화에 대한 보고는 없는 실정이다. 이에 본 연구에서는 322예의 대장암조직의 tissue microarray (TMA)에서 SUMO-2/3의 발현을 면역조직화학적 방법으로 검사하고 이들 결과를 병리조직학적 요인들과 비교분석하여 SUMO-2/3 단백 발현과 대장암과의 관계를 연구하였다.
대상 및 방법
1. 연구 대상
1) 환자 조직
2000년 1월부터 2010년 12월까지 순천향대학교 천안병원에서 병리학적으로 암종으로 확인되어 외과적 수술받은 환자 중 paraffin block의 보존상태가 양호한 322명의 조직을 연구대상으로 하였다.
2) 세포주
대장암 세포주(HCT116, LoVo, SW480, HT29, Colo205)와 정상대장 세포주(CCD-841-CoTr)를 이용하였다.
2. 방법
1) 임상기록 검토
환자의 임상기록을 토대로 성별, 연령 및 방사선학적 검사기록을 조사하였다.
2) 병리조직학적 검색
환자의 조직슬라이드를 재검색하여 조직학적 진단 및 분화도를 정하고 American Joint Committee on Cancer (AJCC, 7th ed.)의 종양 병기지침에 근거하여 tumor (T) 병기를 정하였다.
3) Tissue microarray 제작
환자의 조직 slide를 검색 후 해당 paraffin block에서 각 예마다 2개의 2 mm core를 채취하여 recipient block에 심어 한 block당 30예의 조직을 심었다.
4) 면역조직화학적 염색
TMA block을 4-5 μm 두께로 절편을 만들어 xylene으로 5분간 3회씩 탈 파라핀 시킨 후 100%, 95%, 90%, 70% 및 50%의 ethanol에 각각 3분씩 처리하여 함수시켰다. Antigen retrieval을 위해 0.1 M sodium citrate buffer (pH 6.0)에 15분간 microwave에서 가열시킨 후 실온에서 30분간 식혔다. 그 후 phosphate buffered saline (PBS, pH 7.4)용액으로 세척 후 조직 내의 내인성 과산화 효소의 활성을 억제하기 위하여 0.3% hydrogen peroxide-methanol에 15분간 실온에서 처리 후 증류수로 세척하였다. 절편을 PBS로 세척 후 비 특이적 항원을 차단하기 위하여 30분간 염소 혈청과 반응시킨 후 여분의 용액을 제거하고 일차항원 mouse monoclonal antibody SUMO-2/3 (ATGen, Seoul, Korea) 1:200으로 희석하여 실온에서 2시간 반응시켰다. 그 후 절편을 PBS로 5분간 3회 수세 후 일차항체 enhancer (Biovision, Mountain View, CA, USA)와 30분간 실온에서 반응시켰다. 그 후 PBS로 5분간 3회 수세 후 polymer (Biovision)와 30분간 실온에서 반응시킨 후 다시 PBS로 5분간 3회 수세하였다. 발색은 diaminobenzidine을 사용하였고 Mayer’s hematoxylin으로 약하게 대조염색한 후 다시 graded ethanol로 탈수 후 xylene으로 투명화시켰고 그 후 balsam으로 봉입하여 광학현미경으로 관찰하였다. 면역조직화학적 염색 판독은 핵과 세포질에 염색 정도를 전혀 염색되지 않는 것 0, 경미한 염색 1, 중등도의 염색 2, 강한 염색 3의 4등급으로 구분하였다. 또한 염색 부위를 0-20% 염색 1, 20-60% 염색 2, 60% 이상 염색 3으로 등급 구분하여 염색 정도와 염색 부위의 등급 합이 5 이상을 양성으로 판독하여 통계처리하였다.
5) Western blotting
HCT116, LoVo, SW480, HT29, Colo205, CCD-841-CoTr 각각의 세포를 37°C 5% CO2 humidified incubator를 이용하여 RPMI1640 (+10% fetal bovine serum, +1% adult bovine serum)에서 배양한 후 Western blot을 시행하였다.
BCA protein assay (Pierce, Rockford, IL, USA)를 이용하여 protein의 양을 측정한 뒤 30 μg/μL로 정량한 후 Laemmil Sample Buffer (Bio-Rad, Hercules, CA, USA)와 1:1로 섞은 뒤 100°C에서 10분간 heating 후 ice에서 식혔다. Mini-PROTEAN 4-20% gradient TGX gel (#456-1094)에 sampling한 protein을 30 μL씩 loading 후 100V (400 mA), 60분간 전기영동을 진행하였다. 그 뒤 polyvinylidene fluoride membrane에 Trans-Blot Turbo (Bio-Rad)를 이용하여 transfer하였다. Membrane를 5% skim milk에서 blocking 후 SUMO-2/3 primary antibody (ATGen)를 1:1,500으로 Tris-buffered saline/Tween20 (TBST)를 이용하여 희석 후 4°C에서 overnight 반응시켰다. Secondary antibody (peroxidase labeled anti mouse goat antibody)를 1:1,000으로 TBST를 이용하여 희석 후 실온에서 1시간 반응시켰다. TBST를 이용하여 washing한 뒤 Enhanced chemiluminescene 반응시켰고 chemiluminescent gel document로 detection하였다.
6) 통계처리
임상적 및 병리학적 변수들 간의 상호관계는 chi-square test와 필요에 따라 Fisher’s exact 검사를 시행하였으며 P<0.05를 통계적으로 의의 있는 것으로 하였다. 임상적 및 병리학적 변수들과 SUMO 발현 가능성 정도를 보기 위하여 univariate logistic regression mo-del은 이용하였다.
결 과
1. Western blotting 결과
정상세포주인 CCD-841-CoTr에서의 SUMO-2/3의 발현은 매우 적은 것으로 관찰되었지만 대장암 세포주 HCT116, LoVo, SW480, HT29, Colo205에서는 SUMO-2/3의 높은 발현을 관찰하였다(Fig. 1A). 그리고 5예의 환자 종양조직에서 모두 같은 환자의 정상조직에 비해 SUMO-2/3의 발현이 높은 것으로 관찰되었다(Fig. 1B).
2. 대장 정상조직과 암종에서의 Small Ubiquitin-related Modifier-2/3 발현
대장암종에서의 SUMO-2/3 발현은 핵과 세포질에 발현되었다. 종양조직 근처의 정상조직이 포함된 24예의 정상조직 모두에서 음성을 보였고 암종 인접 정상 상피세포에서는 SUMO-2/3의 핵 내 발현이 관찰되었다. Adenoma에서 발생한 암종에서는 adenoma의 핵 내 발현이 관찰되지 않은 반면 암종의 핵 내에서는 강한 발현을 보였다. 분화도에 따른 SUMO-2/3의 발현은 분화도가 좋은 종양에서는 발현되지 않은 반면 분화도가 낮은 암종에서는 세포질과 핵 내에 강한 발현이 관찰되었다(Figs. 2, 3).
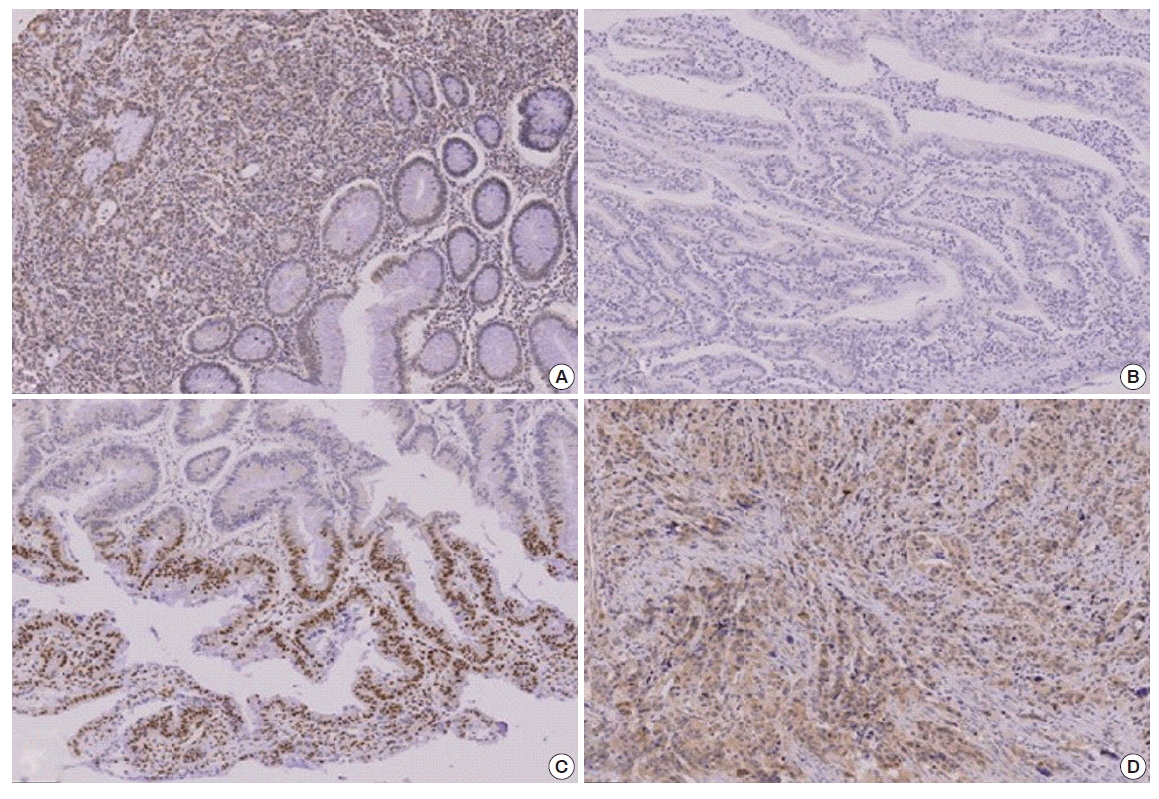
(A) The poorly differentiated carcinoma showed strong small ubiquitin-related modifier (SUMO)-2/3 expression in the nuclei of the tumor cells. The adjacent normal epithelial cells did not express SUMO-2/3 at all. (B) Moderately differentiated carcinoma showed negative expression of SUMO-2/3. (C) The SUMO-2/3 clonally expressed in the well differentiated carcinoma. (D) The infiltrating poorly differentiated carcinoma showed strong SUMO-2/3 expression both in the nucleus and in the cytoplasm (IHC-peroxidase, × 200).
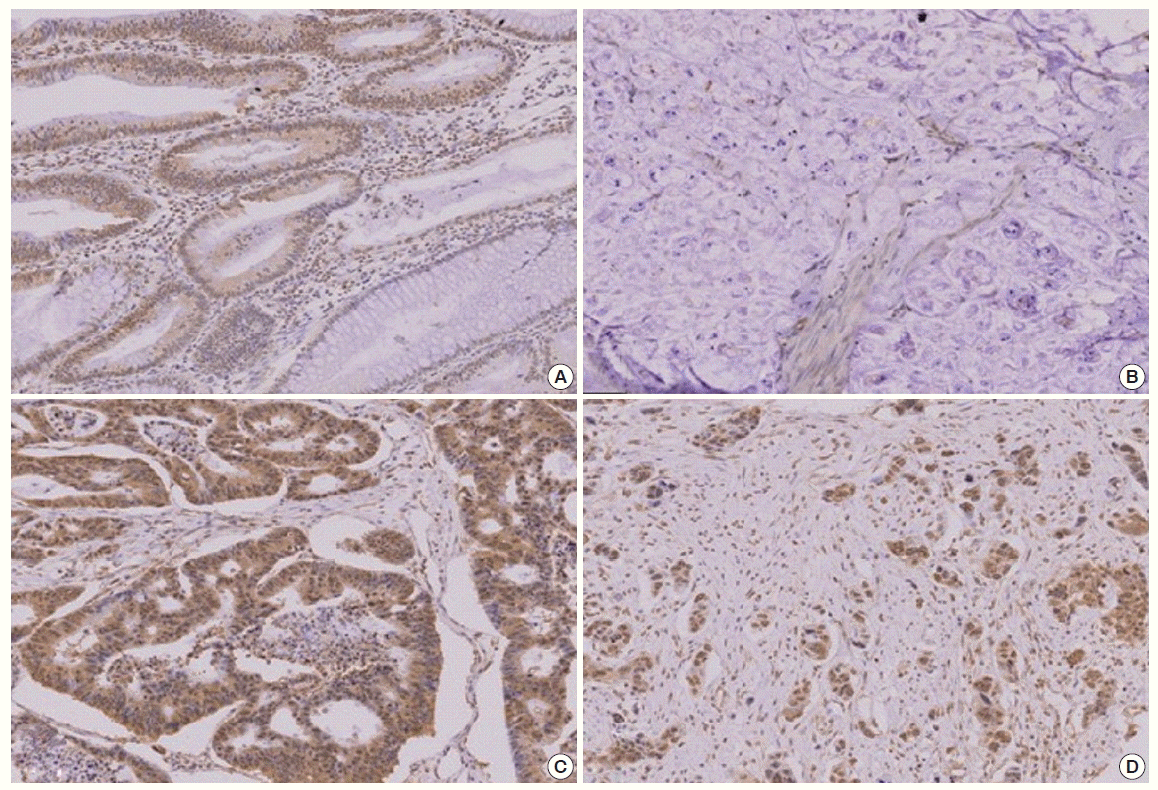
(A) Well differentiated carcinoma expressed small ubiquitin-related modifier (SUMO)-2/3 weakly in the cytoplasm. The normal adjacent cells did not express SUMO-2/3. (B) The mucinous carcinoma did not express SUMO-2/3. (C) Moderately differentiated carcinoma showed strong SUMO-2/3 expression both in the cytoplasm and in the nucleus. (D) The poorly differentiated, infiltrative carcinoma showed strong SUMO-2/3 expression both in the nucleus and in the cytoplasm (IHC-peroxidase, × 200).
3. Small Ubiquitin-related Modifier-2/3 발현과 임상적 및 병리학적 변수들 간의 상관관계
총 322예의 대장암종 중 220예(68.3%)에서 SUMO-2/3의 강한 핵/세포질 내의 발현이 관찰되었다. 임상적 변수와의 SUMO-2/3 발현 여부를 Student t-test와 chi-square test를 통해 통계학적으로 분석해본 결과(Table 1), 연령, T stage, nodal (N) stage, 혈관 침윤 및 림프관 침윤에서도 통계학적 의의를 찾을 수 없었다. 하지만 암종의 분화도에서는 moderate differentiation에서 SUMO-2/3의 발현이 높은 것으로 나타났다(P=0.031). 단변량분석(Table 2)에서 성별, pathological nodal status (pN stage)와의 유의성이 없는 것으로 나타났지만, pathological tumor stage (pT stage, P=0.031)와 분화도 moderate differentiation에서 SUM-O2/3 발현이 높은 것으로 나타났다(P=0.017).
고 찰
세포의 생명활동을 유지하기 위해서 단백질의 기능이 매우 중요한 역할을 한다. 단백질은 유전자의 전사 후 전사 후 수정과정을 통하여 그 기능이 섬세히 조절되는데 이러한 조절의 향상성이 깨지면 각종 질병과 암이 발생하여 생명이 위협받게 된다. 전사 후 수정에는 인산화, 아세틸화, 메틸화 및 유비퀴틴화 등이 있는데 이들 중 유비퀴틴과 SUMO들은 다른 단백질과 결합하여 단백질의 안정과 기능조절에 중요한 역할을 한다[1]. 유비퀴틴과 기질 간의 결합은 기질분자의 lysine과 유비퀴틴 C-terminal의 glycine과 isopeptide 결합과 E1, E2 및 E3 효소들에 의한 multi-enzyme cascade 등 두 방법들로 이루어진다. 유비퀴틴과 결합되어 분해 표지된 기질은 26S proteosome에 의하여 인지되고 따라서 이에 의하여 분해된다. 유비퀴틴은 25년 전에 발견되었고 SUMO는 발견된 지 10년 정도 된 물질이지만 이의 세포생명현상 유지에 중요한 역할이 많이 알려지게 되었다[4-8]. 포유동물세포는 SUMO-1, -2, -3 및 -4 단백을 발현하는데 이 중 -2와 -3은 구조 및 기능이 비슷하여 같은 물질이 아닌지에 한 의혹이 있기 때문에 SUMO-2/3으로 표기하기도 한다. 그러나 SUMO-1은 SUMO-2/3과 구조적으로 다르고 또한 기능도 다르다. SUMO-4의 유전자 code는 밝혀졌으나 세포 내에서 이의 발현 및 기능에 대해서는 잘 알려져 있지 않다[9]. SUMO-2/3의 표적단백과 결합은 표적단백의 ΨKXE일 때 K (lysine)에 SUMO가 결합한다. Ψ란 큰 hydrophobic amino acid residue를 의미한다. SUMO의 결합은 3단계로 구분할 수 있다. 먼저 E1 (SUMO activation enzyme)이 SUMO의 C-terminal을 adenosine triphosphate를 이용하여 활성화시킨다. 이어 E2 (SUMO conjugating enzyme 또는 Ubc9이라고도 함)로 전달되고 다시 E3 (SUMO-protein ligase)의 도움을 받거나 혹은 독립적으로 표적단백질에 연결된다[10]. SU-MO-1과 SUMO-2/3의 차이점은 SUMO-1은 세포 내에 다른 단백에 결합상태로 존재하는 반면 SUMO-2/3은 유리형태(free form)로 존재하다가 세포가 어떤 stress를 받으면 바로 표적단백에 결합하여 conjugation이 된다. 세포단백의 SUMOylation은 세포의 정상적 생명현상에 매우 중요한 역할을 하지만 비정상적인 SUMOyla-tion은 악성종양 발생뿐만 아니라 신경변성질환(neurodegenerative disease) 및 심장병들을 일으킬 수 있다[11]. SUMOylation과 연관된 물질들이 암발생과 관련 있음이 알려졌는데[12,13] 예로 Ubc9 (SUMO conjugating enzyme, E2)은 사람의 악성종양이 발현 증가가 관찰되었을 뿐 아니라 이의 발현 증가는 암세포성장을 촉진시킨다[14,15]. 활성화된 STAT3를 억제하는 SUMO E3 protein PIAS3은 다양한 종양에서 발현 증가가 관찰되고 있으며[16] SUMO E1 효소의 발현 증가는 간세포암 환자에서 생존율 감소와 관련 있음이 알려졌다[17]. 또한 SUMOylation은 암억제유전자인 p53, pRB, p63, p73 및 Mdm2 등의 활성에 관여함으로 악성종양 발생에 일조하기도 한다[18]. 또한 SUMOylation은 유방암과 전립선암 발생에 관여하기도 한다. 유방암 발생에 관련 있는 BRCA1에 SUMO-2/3이 결합되면 BRCA1이 androgen receptor에 직접적으로 작용하여 receptor 기능을 항진시켜 전립선암 발생에 기여한다[19,20]. 또한 deSUMOylation 효소인 SUMO protease SENP1은 전립선암과 갑상선암에서 발현 증가가 관찰되며 이의 발현 증가는 전립선암 발생을 촉진시키기도 한다[21]. 암발생의 외적 요인 중 유전물질의 돌연변이를 유도하는 방사선, 다양한 종류의 화학적 발암물질 및 체내에서 생성되는 활성산소 등을 들 수 있다. 그러나 이들 이외에 유전자 돌연변이가 없어도 유전자 집합체인 염색체의 불안정화가 암발생의 한 원인이 되기도 한다. 염색체의 안정화를 위해서는 염색체에 부착되어 있는 특수구조물인 동원체, 텔로메어 등의 안정화가 필수적인데 이런 유전자 집합체인 염색체는 여러 단백의 결합에 의하여 외부의 유해 자극으로부터 보호되지만 이 기능이 없으면 염색체가 불안정해 짐으로 암을 비롯한 다양한 질병이 발생된다. SUMO는 이러한 염색체의 이질염색체(heterochromatin)의 조절에 중요한 역할을 한다. 즉 SUMO는 염색체 안정화에 중요한 역할을 하는 여러 가지 단백질의 기능을 조절해주는데 이러한 SU MO의 기능에 이상이 있을 때 악성종양이 발생하기도 한다[22]. 이 외에 SUMO-2/3 conjugating enzyme 인 E2 (Ubc9)의 발현 증가는 폐선암종, 흑색종, 유방암 및 난소암 등에서 관찰된다[23]. p53는 세포유전자의 위해가 가해졌을 때 위해로부터 세포를 보호함과 아울러 위해 받은 유전자의 복구를 도와줌으로 암발생을 억제해주는 암억제유전자의 대표적인 물질이다. 따라서 p53의 대사에 관여하는 모든 물질들은 암발생과 직접적 혹은 간접적으로 관련이 있다. Mdm2는 p53 기능을 조절하는 물질 중 하나이다. Mdm2는 SUMOylation의 표적 물질로 E3 ligase 작용을 한다[24]. 그러나 아직은 Mdm2의 SUMOylation과 p53의 안정성과의 관계가 학문적으로 확실시된 것은 아니나 최근 SUMOylation과 deSUMOylation에 의한 Mdm2의 기능조절 기전이 밝혀지고 있다[25]. SUMOylation된 Mdm2는 Mdm2의 자가 유비퀴틴화를 감소시켜 정상적인 상태에서 p53의 양이 감소되도록 조절해준다. SUSP4는 Mdm2의 deSUMOylation 효소인데 UV에 의하여 DNA가 손상 받으면 SUSP4가 증가하여 Mdm2의 deSUMOylation이 일어나고 Mdm2의 자가 유비퀴틴화(self-ubiquitination)가 촉진된다. 이러한 결과로 p53가 안정화되어 p53 의존적인 세포사멸과 세포성장억제 등이 이루어진다[23]. 암전이는 악성세포가 혈관 내로 이동하며 다른 장기로 퍼지는 현상을 말하며 이러한 현상으로 암에 의한 사망률이 높게 된다. 이러한 암전이는 암 연구의 최종목표라 할 수 있는 어려운 문제가 되고 있다. 최근에 SUMO가 암전이에 대한 조절 역할을 한다는 연구결과가 발표되었다. KA11은 NF-kB의 표적유전자로 암전이억제유전자 기능을 한다. 최근 KA11유전자의 암전이억제가 Tip60과 beta-catenin을 통하여 이루어진다는 것이 밝혀졌다. 비전이 암세포에서는 상대적 발현량이 많은 Tip60의 기능으로KA11이 발현되어 암전이가 억제되지만 전이 암세포에서는 전사억제 복합체로 작용하는 beta-catenin과 reptin의 양이 상대적으로 증가되어 Tip60 의 급격한 감소를 초래하고 따라서 KA11 발현이 억제되어 암전이가 유발된다[26]. 최근에 SUMO가 전이억제유전자인 KA11발현을 조절한다는 사실이 밝혀졌다[23].
SUMO의 기능을 다양한 문헌고찰로 검토해본 결과 SUMO는 암발생과 전이에 직접 혹은 간접적으로 관여함을 알 수 있었다. 그러나 대장암종 발생과의 관련에 대해서는 아직까지 보고가 없는 실정이다. 따라서 본 연구에서는 322의 대장암을 대상으로 SUMO-2/3의 발현을 면역조직화학적으로 조사하여 이의 결과를 임상 및 병리학적으로 검토하였다. 본 연구에서 총 322예의 대장암 중 220예(68.3%)에서 SUMO-2/3의 강한 발현이 종양세포의 핵과 세포질 내에서 관찰되었다. 이로 미루어 볼 때 SUMO-2/3의 발현은 대장암 발생과 관련 있음을 알 수 있다. 또한 SUMO-2/3의 발현은 성별, 연령, pT, pN, 혈관전이, 림프관전이 등과의 통계학적 유의성은 없는 반면 moderated differentiation에서 통계학적 유의성을 보여 SUMO-2/3의 발현과 분화도가 관련이 있는 것으로 나타났다. 단변량분석에서는 pT stage에서 stage가 높을수록 SUMO-2/3의 발현이 높은 것으로 나타났다. 따라서 대장암종에서 SUMO-2/3의 발현은 암발생과 진행에 역할을 한 것으로 생각된다.