ABSTRACTAnti-tumor necrosis factor (TNF)-α therapy is being increasingly used to treat several rheumatic diseases and inflammatory bowel diseases. However, treatment with anti-TNF-α therapy of patients with a concurrent hepatitis B virus (HBV) or hepatitis C virus (HCV) infection can promote viral reactivation and potentially fatal liver failure. The medical records of 176 patients who had been treated with an anti-TNF-α therapy at single center from January 2010 to December 2012 were retrospectively analyzed. Of the 176 patients, the hepatitis B surface antigen (HBsAg) status of 114 (64.8%) were tested at the baseline. Five (4.4%) of them were HBsAgpositive, and 109 (95.6%) were negative. Only 10 of the HBsAg-negative patients (9.2%) were checked for hepatitis B core antigen. Ninety-one patients were checked for anti-HCV, and two (2.2%) were positive. After their anti-TNF-α therapy, HBV reactivation was confirmed in two patients. The reactivation of HBV after the anti-TNF-α therapy was observed in the HBsAg-positive patients.
서 론Tumor necrosis factor (TNF)-α는 대표적인 염증성 T-helper 1 사이토카인으로 이는 숙주의 자연면역과 특이면역에서 다양한 역할을 담당한다[1]. 특히 anti-TNF-α therapy는 류마티스 관절염이나 강직성 척추염과 같은 류마티스질환뿐만 아니라 크론병이나 궤 양성대장염과 같은 염증성 장질환 환자에서 효과적인 치료제로 사용되고 있다[2,3]. 현재 널리 쓰이는 anti-TNF-α therapy로는 infliximab, etanercept, adalimumab 등이 있으며 그 사용량이 지속적으로 늘어나고 있다.
Anti-TNF-α therapy의 가장 큰 부작용은 숙주의 면역체계에 영향을 미쳐 결핵이나 바이러스에 의한 기회감염의 발생률을 높인다는 데 있다[4]. 특히 anti-TNF-α therapy 후에 발생하는 B형간염의 재활성화는 전격성 간염으로 진행하여 사망률을 증가시키거나 기저질환의 치료 지연을 초래하기도 한다. 이러한 B형간염의 재활성화는 anti-TNF-α therapy 전, 환자가 만성B형간염 상태(B형간염 표면 항원[hepatitis B surface antigen, HBsAg] 양성)인 경우 발생 확률이 높아지며 최근에 이러한 환자에서 B형간염에 대한 선제치료가 권고되고 있다[2,5]. 그러나 HBsAg 음성인 환자에서도 anti-TNF-α therapy 후에 B형간염의 재활성화가 보고되고 있는데[5,6], 이는 B형간염 바이러스(hepatitis B virus, HBV)에 감염된 후 회복되었다 하더라도 혈청이나 간 조직 내에 낮은 수준의 HBV는 존재할 수 있기 때문이다. 이러한 경우 HBsAg은 음성으로 나타나지만 HBVDNA가 검출되거나 B형간염 중심항체(hepatitis B core antigen, anti-HBc) 양성을 보이는데, 이를 잠재감염이라고 하고 이러한 잠재감염 상태에서 anti-TNF-α therapy를 받는 경우 HBV의 복제가 증진되어 재활성화가 나타나는 것이다. 본 연구의 목적은 anti-TNF-α therapy 후, 발생한 2 case의 B형간염의 재활성화에 대해 알아보고 이를 방지하기 위한 전략을 알아보고자 하는 데 있다.
본 연구는 가천대 길병원에서 2010년 1월부터 2012년 12월까지 anti-TNF-α therapy (infliximab, etanercept, adalimumab)를 받은 176명의 환자에 대해 후향적 연구분석으로 이루어졌다. 연구에 참여한 모든 환자에 대해 anti-TNF-α therapy 전 B형, C형간염 바이러스의 상태, 혈청 aspirate aminotransferase (AST), alanine aminotransferase (ALT), HBV-DNA 정량검사에 대한 자료를 후향적으로 분석하였다. B형, C형간염의 항원항체검사(HBsAg/Ab, anti- HCV)는 enzyme immunoassays (Abbott Laboratories, Chicago, IL, USA)를 이용하여 측정하였으며, anti-HBc은 radioimmunoassay (Corab; Abbott Laboratories)를 이용하였다. 혈청 HBV-DNA 정량검사는 real time-polymerase chain reaction (Abbott Laboratories)를 사용하였다.
Anti-TNF-α therapy를 받는 모든 환자는 외래 추적관찰하며 4-6주마다 AST/ALT level을 검사하였다. 또한 anti-TNF-α therapy 전 HBsAg 양성 환자와 HBsAg 음성이면서 anti-HBc 양성 환자군의 경우 1년 간격으로 HBV-DNA 정량검사를 하였으며, 매 4-6주마다 측정한 AST/ALT level이 증가 소견으로 보일 시에 HBV-DNA 정량 검사를 추가적으로 시행하였다.
본 연구에 참여한 총 176명의 환자 중, 113명이 infliximab, 40명이 etanercept, 23명이 adalimumab 치료를 받았으며, 그 중 114명 (64.8%)의 환자들이 anti-TNF-α therapy 전 HBsAg에 대해 검사를 받았다. 검사를 받은 114 중 5명(4.4%)이 HBsAg 양성 환자였으며, 109명(95.6%)은 HBsAg 음성 환자였다. 그러나 anti-HBc에 대한 anti-TNF-α therapy 전 검사는 HBsAg 음성인 환자 109명 중에 10명(9.2%)에서만 이루어졌으며, 이 중 2명(20%)이 anti-HBc 양성, 8명(80%)이 음성 환자였다(Fig. 1A). Anti-HCV에 대한 검사는 총 176명 중 91명(52%)에서 이루어졌으며, 그 중 2명에서 양성소견으로 보였다(Fig. 1B).
Anti-TNF-α therapy 후에 B형간염 재활성화는 HBsAg 양성인 경우와 음성인 경우 각각 달리 적용되는데, HBsAg이 양성인 경우 재활성화가 되었다고 해도 혈청학적 표지자들의 변화는 사실상 거의 없기 때문에 HBV-DNA 농도변화에 따라 판단하게 된다. B형간염 재활성은 anti-TNF-α therapy 후, HBV-DNA 농도가 치료 전에 비해 10배 이상 상승되거나 측정된 HBV-DNA가 109 copies/mL 이상일 때로 정의하였으며, HBsAg 음성의 경우는 이전에 B형간염을 앓고 회복된 후 또는 잠재감염의 상태로 있다가 anti-TNF-α therapy에 의해 바이러스 재활성이 나타나는 경우가 흔하다. 따라서 HBsAg 음성인 환자의 재활성은 치료 중 혈액 내 HBsAg이 재출현하거나 HBV-DNA가 재검출되는 경우로 정의하였다[7,8].
176명의 환자 중에 anti-TNF-α therapy 후에 B형간염의 재활성화로 판명된 환자는 총 2명이었으며, 이들 모두 HBsAg 양성인 환자였다. 이들 중 치료 전, 선제 치료를 받은 환자는 없었으며 1명은 모두 대증적인 치료로 완전히 회복되었으나 나머지 1명은 entecavir 0.5 mg/day 복용 후에 회복되었다. Anti-TNF-α therapy 전, HBsAg, anti-HCV검사를 모두 하지 않은 환자 62명과 anti-HCV 양성인 2명의 환자에서는 추적관찰 중에 시행한 AST/ALT는 정상수치였으며 특이한 합병증 없이 anti-TNF-α therapy를 종료하였다.
증 례1. 증례 139세 남자 환자로 지속적인 허리 통증으로 2010년 류마티스 내과 외래 내원하였으며 혈청검사에서 human leukocyte antigen-subtype B27 (HLA-B27) 양성반응 보이며 골반 magnetic resonance imaging에서 오른쪽 sacroilitis 소견을 보여 강직성 척추염을 진단받고 1개월간 비스테로이드성 소염진통제를 복용하였으나 통증이 호전되지 않아 prednisolone 7.5 mg/day, sulfasalazine 1 g/day을 1달간 복용하였다. 그러나 통증이 지속되어 anti-TNF-α therapy를 시작하였으며, 치료 전 간기능검사와 B형간염의 항원항체검사결과는 다음과 같았다. ALT 32 IU/L, HBsAg 양성, hepatitis B surface antibody (HBsAb) 음성이었다. 그는 2010년 10월부터 adalimumab 40 mg/2 wk 주기로 치료를 시작하였으며 외래 경과관찰 중에 치료 시작 8개월 후에 시행한 ALT가 132 IU/L로 증가되어 시행한 HBV-DNA 정량검사에서 1.4×109 copies/mL 소견을 보였다. 이후 환자는 entecarvir (0.5 mg/day) 복용 후에 간기능검사에서 정상 소견을 보였으며, 간염의 합병증 없이 회복되었으며 anti-TNF-α therapy는 중단 후, 비스테로이드성 소염진통제만으로 통증 조절이 잘되어 외래 경과관찰 중이다.
2. 증례 2환자는 37세 남자로 평소 지속적인 목통증과 허리통증으로 2004년 류마티스 내과 외래 내원하였으며 HLA-B27 양성반응을 보이며 골반 X-ray검사에서 양측성 sacroilitis 소견을 보여 강직성 척추염으로 진단받고 비스테로이드성 소염진통제를 복용하였으나 증상 호전이 보이지 않아 anti-TNF-α therapy를 시작한 환자이다. 이 환자의 치료 전 간기능검사와 B형간염의 항원항체검사결과는 다음과 같았다. ALT 44 IU/L, HBsAg 양성, HBsAb 음성이었다. 그는 2012년 8월부터 inflixamab 345 mg/2 wk 주기로 치료를 시작하였으며 외래 경과관찰 중에 치료 시작 8개월 후에 시행한 ALT가 88 IU/L로 증가되어 시행한 HBV-DNA 정량검사에서 9.8×104 copies/mL 소견을 보였으며 이후 3개월간 inflixamab을 중단 후에 ALT가 27 IU/L까지 감소하여 inflixamab 재투여를 시작하였다. 그러나 치료 재시작 7개월 후에 ALT가 65 IU/L로 상승하였으며 이에 시행한 HBV-DNA 정량검사에서 1.8×106 copies/mL로 상승되어 있었다. 이후 환자는 inflixamab을 중단하였으며 후에 ALT가 정상 소견으로 회복되었다(Table 1).
고 찰최근 anti-TNF-α therapy의 확대는 기존 치료에 반응이 좋지 않았던 여러 자가면역질환에서의 치료 성공률을 높이고 있다[9]. 그러나 anti-TNF-α therapy는 기존 숙주의 자가면역계에 영향을 주어 결핵이나 바이러스감염에 의한 기회감염의 부작용 발생률을 높이고, 이로 인한 기저질환의 치료 연장뿐 아니라 기회감염 자체에 의한 사망률을 증가시킬 수 있다[9,10]. 이 중 B형간염의 재활성화는 anti-TNF-α therapy 전, HBsAg 양성인 환자뿐만 아니라, HBsAg 음성이지만 anti-HBc가 양성인 환자에서도 발생할 수 있다[11]. HBV는 전 세계적으로 4억 명의 만성B형간염 환자가 있고, 과거감염이나 잠재감염인(HBsAg 음성, anti-HBc 양성) 인구는 16억명에 달하고 있다. 그러므로 anti-TNF-α therapy를 받는 환자에서 B형간염의 재활성화율을 낮추고 위험인자를 미리 예방하는 것이 무엇보다 중요하다. Anti-TNF-α therapy 후 발생하는 B형간염 재활성화의 기전은 TNF-α가 숙주 면역체계와 일으키는 상호관계에 있다. Anti-TNF-α therapy 후에 낮아진 TNF-α level은 cytokine cascade의 시작과 전개를 불안정하게 하며, Fas/Fas ligand-mediated apoptosis를 통한 hepatocyte clearance를 저해한다. 또한 낮은 TNF-α level과 상대적으로 높은 interferon-γ의 불균형은 CD8+ T-cell 반응을 저해하여 hepatocyte clearance 및 HBV-DNA clearance를 저해하여 지속적인 간세포 파괴를 조장한다[7,11]. 또한 infliximab는 피하주사로 맞는 다른 anti-TNF-α therapy에 비해 정맥주사로 맞기 때문에 빠르게 혈청 내 최고 농도에 다다를 수 있으며, infliximab의 Fc portion은 다른 anti-TNF-α therapy에 비해 더욱 강력한 complementdependent cytotoxicity를 가지고 있으며 chimeric monoclonal antibody는 transmembrane TNF-α dependent apoptosis를 일으키는 더욱 강력한 유발인자로 작용함으로써 다른 anti-TNF-α therapy보다 infliximab 사용군에서 B형간염의 재활성화율이 높게 보고되고 있다[12].
최근 한 연구에서 선제치료를 받지 않은 49명의 만성B형간염 환자에서 anti-TNF-α therapy 후 B형간염의 재활성화가 6.9%임을 보고한 바 있고, 이에 비해 HBsAg 음성, anti-HBc 양성인 환자에서의 재활성화는 케이스 보고된 바는 있으나 발생률은 매우 낮은 것으로 보고 있다[3,5]. 현재까지 보고된 anti-TNF-α therapy 후에 발생하는 B형간염의 재활성화율을 살펴보면 49명의 HBsAg 양성인 강직성 척추염 환자군에서 3명(6.1%)의 B형간염의 재활성화가 확인되었고, 이들은 모두 entecavir 복용 후에 간염의 합병증 없이 정상 간기능을 회복하였다. 8명의 HBsAg 양성의 강직성 척추염 환자를 대상으로 한 또 다른 연구에는 1명(12.5%)에서 재활성화가 일어났으며, 5명의 HBsAg 양성인 류마티스 관절염 환자에서의 연구에서는 2명(40%)의 높은 재활성화율을 보였다. 이에 비해 잠재감염을 의미하는 HBsAg 음성이며 anti-HBc 양성인 환자군에서의 연구에서는 45명의 류마티스 관절염 환자에서 1명(2.2%)에서 재활성화가 있었으며, 또 다른 연구에서는 70명의 류마티스 관절염 환자에서 1명(1.4%)의 재활성화율을 보고하고 있어, HBsAg 양성인 환자에 비해 매우 낮은 재활성화율을 확인할 수 있었다(Table 2). 이와 비교해 본 연구결과는 HBsAg 양성 환자 6명 중 2명이 anti-TNF-α therapy 후 재활성화 소견을 보였으며 이는 기존의 연구에 비해 높은 발생률을 보이고 있었다. 이에 현재는 HBsAg 양성 환자에서는 anti-TNF-α therapy 전 HBV에 대한 선제 치료가 권고되고 있으며[6,10], 가천대 길병원 환자 중에 선제 치료를 받은 환자는 없었으며 이러한 이유가 B형간염의 재활성화율을 높였다고 보여진다.
본 연구의 제한점은 후향적 연구이며 anti-TNF-α therapy 전 HBV 표지자에 대한 검사가 충분히 이루어지지 않아 B형간염 재활성화 고위험군에 대한 선별과 정기적인 추적관찰이 적절하게 이루어지지 못한 데 있다. 그러나 본 연구는 단일기관에서 3년간 anti-TNF-α therapy를 받은 환자에서 B형간염의 재활성화율과 각각의 케이스를 살펴봄으로써 anti-TNF-α therapy 후에 B형간염 재활성의 위험인자와 예방하기 위한 전략을 알아볼 수 있었다.
Anti-TNF-α therapy를 계획하고 있는 모든 자가면역 환자들에서 anti-TNF-α therapy 후 B형간염의 재활성화를 예방하기 위해서는 무엇보다 치료 전, 환자의 B형간염 상태에 대한 정확한 평가를하는 것이 가장 중요하다. 이때 HBsAg 양성인 환자군에서는 anti- TNF-α therapy 전, 항바이러스제의 선제치료가 반드시 필요하며, HBsAg 음성일지라도 anti-HBc 양성인 환자군에서 B형간염의 재활성화가 발생할 수 있으므로 이에 대한 예방을 위해 anti-TNF-α therapy 전, HBsAg 음성인 환자에서 반드시 anti-HBc 유무에 대한 검사가 이루어져야 한다.
Anti-TNF-α therapy 후 B형간염의 재활성화는 심각한 간 부전 뿐만 아니라 기저질환 치료의 연기 및 조기 중단을 초래하여 사망률을 높일 수 있는 주요한 합병증인 만큼 이에 대한 치료 전 예방이 무엇보다 중요하며 이를 위해서는 anti-TNF-α therapy 전, 환자의 HBV에 대한 평가와 선제치료가 정확히 이루어져야 한다.
Fig. 1.(A) Hepatitis B virus (HBV) status before the anti-tumor necrosis factor (TNF)-α therapy and reactivation rate after the anti-TNF-α therapy. (B) Hepatitis C virus (HCV) status before the anti-TNF-α therapy. Values are presented as number (%). HBsAg, hepatitis B surface antigen; HBcAb, hepatitis B core antibody. 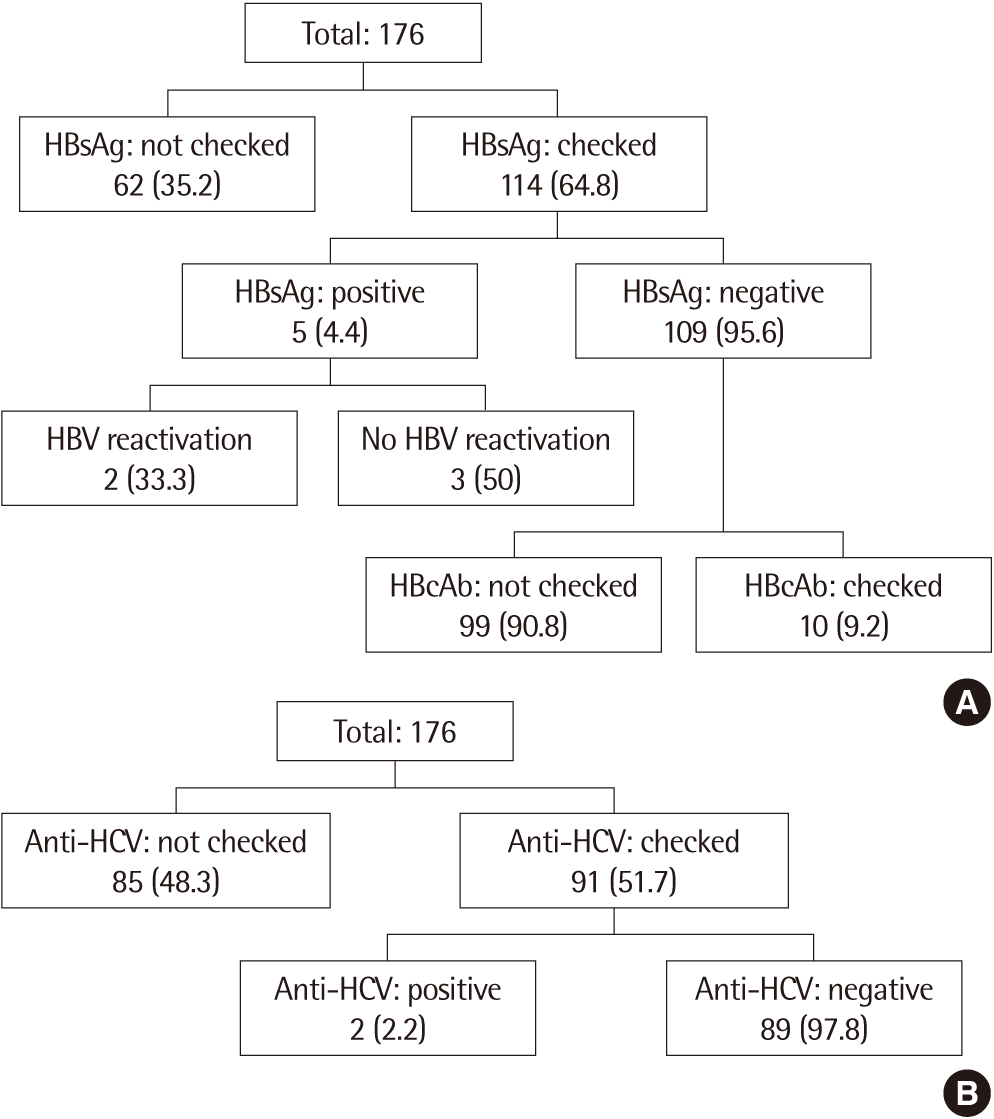
Table 1.Summary of the reported 2 cases of HBV reactivation Table 2.Summary of the reported cases of HBV reactivation in HBsAg-positive and negative patients
REFERENCES1. Cheong JY, Cho SW, Hahm KB, Yoon SK, Lee JH, Park CS, et al. Association between chronic hepatitis B virus infection and tumor necrosis factor-alpha gene promoter polymorphisms. Korean J Med 2005;68: 619-27.
2. Ryu HH, Lee EY, Shin K, Choi IA, Lee YJ, Yoo B, et al. Hepatitis B virus reactivation in rheumatoid arthritis and ankylosing spondylitis patients treated with anti-TNFα agents: a retrospective analysis of 49 cases. Clin Rheumatol 2012;31: 931-6.
3. Navarro R, Vilarrasa E, Herranz P, Puig L, Bordas X, Carrascosa JM, et al. Safety and effectiveness of ustekinumab and antitumour necrosis factor therapy in patients with psoriasis and chronic viral hepatitis B or C: a retrospective, multicentre study in a clinical setting. Br J Dermatol 2013;168: 609-16.
4. Caporali R, Bobbio-Pallavicini F, Atzeni F, Sakellariou G, Caprioli M, Montecucco C, et al. Safety of tumor necrosis factor alpha blockers in hepatitis B virus occult carriers (hepatitis B surface antigen negative/anti-hepatitis B core antigen positive) with rheumatic diseases. Arthritis Care Res (Hoboken) 2010;62: 749-54.
5. Vigano M, Degasperi E, Aghemo A, Lampertico P, Colombo M. Anti-TNF drugs in patients with hepatitis B or C virus infection: safety and clinical management. Expert Opin Biol Ther 2012;12: 193-207.
6. Chung SJ, Kim JK, Park MC, Park YB, Lee SK. Reactivation of hepatitis B viral infection in inactive HBsAg carriers following anti-tumor necrosis factor-alpha therapy. J Rheumatol 2009;36: 2416-20.
7. Tanaka E, Urata Y. Risk of hepatitis B reactivation in patients treated with tumor necrosis factor-α inhibitors. Hepatol Res 2012;42: 333-9.
8. Carroll MB, Forgione MA. Use of tumor necrosis factor alpha inhibitors in hepatitis B surface antigen-positive patients: a literature review and potential mechanisms of action. Clin Rheumatol 2010;29: 1021-9.
9. Vassilopoulos D. Should we routinely treat patients with autoimmune/ rheumatic diseases and chronic hepatitis B virus infection starting biologic therapies with antiviral agents? Yes. Eur J Intern Med 2011;22: 572-5.
10. Tamori A, Koike T, Goto H, Wakitani S, Tada M, Morikawa H, et al. Prospective study of reactivation of hepatitis B virus in patients with rheumatoid arthritis who received immunosuppressive therapy: evaluation of both HBsAg-positive and HBsAg-negative cohorts. J Gastroenterol 2011;46: 556-64.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||