SMS 2011 December;17(2):138-142.
Published online 2011 December 30 |
| Copyright ⓒ 2010 Soonchunhyang Medical Science
|
| A Case of Multiple Liver Metastasis of True Gastric Leiomyosarcoma after Complete Surgical Resection |
| Se Yoon Park1, Chang Kyun Lee1, Jun Seok Park1, Byung Kyu Ahn1, Se Hun Kim1, Suck Ho Lee1, Il Kwun Chung1, Sun Joo Kim1, Chang Jin Kim2
|
| Departments of 1Internal Medicine and 2Pathology, Soonchunhyang University Cheonan Hospital, Soonchunhyang University College of Medicine, Cheonan, Korea |
| Corresponding Author: Chang Kyun Lee , Tel: +82-41-570-3741 , Fax: +82-41-574-5762 , Email: cklee92@paran.com
|

|
ABSTRACT
|

|
|
| Primary leiomyosarcomas of the stomach are very rare tumors originating from mesenchymal tissues and account for only 1% of all malignant gastric neoplasm. We present here a case of primary gastric leiomyosarcoma in a 79-year-old man who presented with a 10 day history of epigastric pain and gastric subepithelial tumor. Endoscopic examination showed a 5 cm in diameter, subepithelial tumor located in the body of the stomach. Radiological investigations showed nonspecific findings except for the primary gastric lesion. Complete histological evaluation including immnuohistochemical staining after complete surgical resection revealed a true leiomyosarcoma of the stomach. One year later, the patient presented with dyspepsia. Endoscopic and radiological evaluation showed a recurrent leiomyosarcoma with multiple liver metastases. Our experience suggests that a careful clinical follow-up after surgical resection should be recommended in patients with gastric leiomyosarcomas because of their aggressive clinical behavior. |
|
Keywords: Leiomyosarcoma; Stomach neoplasms; Neoplasm metastasis; Immnunohistochemistry |
|

|
서론
|

|
|
| 평활근육종은 평활근의 분화로 발생하는 비상피성간엽성 종양으로 자궁 및 위장관, 후복강, 폐, 신장 등에서 주로 발생한다
[1]
. 위장관에서 발생하는 비상피성간엽성 종양들은 과거에는 평활근종, 평활근모세포종, 평활근육종 등으로 분류되었으나, 면역조직화학적 검사방법이 발전되면서 평활근육종으로 진단되던 비상피성간엽성 종양의 대부분이 악성 위장관 간질종양임이 확인되어 실제 면역조직화학법을 통하여 확진한 일차성 위 평활근육종의 치료 및 경과에 대한 보고는 드물다
[2]
. 저자들은 위의 상피하 종양을 주소로 전원된 환자에서 악성 위장관 간질종양 의심하에 복강경하 쐐기 절제술을 시행하여 고등급의 일차성 위 평활근육종을 진단하였고, 완전 절제 1년 뒤 발생한 국소 재발과 다발성 간전이를 경험하였기에 문헌 고찰과 함께 보고하는 바이다. |

|
증례
|

|
|
| 79세 남자 환자가 10일 전부터 시작된 식후 악화되는 상복부 통증 및 내시경검사에서 발견된 상피하 종양을 주소로 전원되었다. 내원 당시 혈압 150/80 mmHg, 맥박수 80회/min, 체온 36.6˚C였으며 의식은 명료하였다. 말초혈액검사에서 혈색소 12.8 g/dL, 백혈구 5,870/mm3, 혈소판 212,000/mm3이었다. 종양표지자검사는 α-FP 4.86 ng/mL (0-20.0 ng/mL), careinoembryonal antigen 2.06 ng/mL (0-5.0 ng/mL), carbohydrate antigen 19-9 3.69 IU/mL (0-37 IU/mL)로 정상이었다. 기타 혈청생화학검사, 간기능검사 및 전해질검사에서 이상 소견은 없었다. 환자는 외부 병원에서 시행한 상부위장관 내시경검사에서 위체부후벽에 원형으로 돌출되어 있고 정상 점막으로 덮여 있는 약 5.0 cm 크기의 상피하 종양이 관찰되었다. 내시경초음파검사에서 경계가 비교적 명확한 4.6×4.2 cm 크기의 병변이었으며, 바깥 돌림근육층에서 기원하여 장막 쪽으로 돌출하는 양상이었고, 내부에는 불균일한 저에코 및 낭성 변화(cystic change)가 관찰되었다
(Fig.1)
. 주변 림프절 종대는 관찰되지 않았다. 복부 전산화단층촬영(computed tomography, CT)에서 외강으로 돌출하는 양상의 약 5.0 cm 크기의 종양이 위체부후벽에 관찰되었고, 양성자 방출 전산화단층촬영에서 동일한 위치에 fluoro-2-deoxy-D-glucose 섭취 증가가 보였으나 다른 장기로의 전이는 관찰되지 않았다. 이상의 검사소견을 바탕으로 위의 악성 위장관 간질종양의 가능성을 고려하여 복강경하 쐐기 절제술을 시행하였다. 조직검사 결과는 위의 고유근층과 장막하층을 침범하는 방추세포 종양으로 면역조직화학염색법에서 c-kit (CD117), CD34, S100에 모두 음성, smooth muscle actin (SMA) 및 desmin에 양성소견을 나타내고, 괴사와 핵다형성(nuclear pleomorphism)이 뚜렷하며 유사분열이 관찰되는 진성 평활근육종으로 판명되었다. 또한 수술 변연에 잔존 종양이 관찰되지 않고, 국소 림프관 및 혈관 침윤이 없어 완전 절제된 것으로 판단하였다
(Fig.2)
. 환자는 수술 이후 1년 동안 무증상을 이유로 추적 관찰이 소실되었다가, 내원 한 달 전부터 발생한 복부 불편감을 주소로 내원하였으며 이에 복부 CT검사와 내시경검사를 시행하였다. 상부위장관 내시경검사에서 위체부후벽 과거 원발 종양의 발생 및 수술부위에 중심부 함몰을 동반한 약 3.0 cm 크기의 상피하 종양이 다시 관찰되었다. 재발의 확진을 위해서는 조직검사가 필요하나 환자의 경우 복부 CT에서 과거 수술 후 봉합물 주위로 처음 진단 시 시행한 복부 CT와 같은 성상의 조영 증강되는 병변이 관찰되었고 간으로 새롭게 발생한 다발성의 병변은 악성 종양의 간전이에 합당한 소견이었다. 양성자 방출 전산화단층촬영에서도 위체부후벽 및 간에서 복부 CT 소견과 일치하는 과대사성병변이 확인되었다
(Fig.3)
. 환자는 6차례의 dacarbazine 400 mg/m2 항암치료를 시행하였으나 항암치료 후 전신 상태가 급격히 악화되었으며 동반된 폐렴으로 사망하였다. |

|
고찰
|

|
|
평활근육종은 평활근의 분화로 발생하는 대표적인 비상피성간엽성 종양의 하나로 후복강과 복강, 혈관 및 연부 조직 등에서 주로 발생하는 것으로 알려져 있으나 위에서 발생한 일차성평활근육종은 그 빈도가 드물어 전체 위의 악성종양에서 1%의 빈도를 갖는 것으로 보고되고 있다
[3]
. 특히 면역조직화학염색법이 발달되지 않고 위장관 간질종양(gastrointestinal stromal tumor)의 병태생리가 알려져 있지 않던 과거에는 악성 위장관 간질종양의 대부분이 평활근육종으로 진단되었기 때문에 실제 진성 평활근육종의 빈도는 과거의 보고보다는 드물 것으로 생각한다
[2]
. 저자들이 조사한 바에 의하면 위의 평활근육종 4예가 국내에서 보고되고 있는데, 이 중 단 2예에서만 면역조직화학염색법이 시행되었다
[4-6]
. 그러나, 면역조직화학염색법이 시행된 2예에서도 c-kit, CD34에 양성을 나타내고, SMA에 국소 양성 반응을 보였다고 기술되어, 2예 모두 진성 평활근육종이 아닌 실제로는 위장관 간질종양에 합당한 진단이라 할 수 있다. 이번 증례에서 원발 종양은 방추 세포로 구성되어 있으며, 면역조직화학검사법에서 악성 위장관 간질종양 진단에 특이적인 c-kit (CD117), CD34가 모두 음성이고, SMA 강양성, desmin 양성소견을 보이며, S100 음성소견을 보여 위에서 발생한 진성 평활근육종으로 확진할 수 있었다. 이처럼 정확한 면역조직화학염색법이 시행되면 진성 평활근육종의 진단은 어렵지 않으나 진단이 불확실한 과거 국내 보고로부터 질병경과를 유추하고 추적 관찰 방침을 참조할 수 있는 우려가 있어 임상의사의 주의가 필요하다.
위에서 발생한 평활근육종은 강외로 서서히 자라는 특징이 있어, 증상 발현이 늦고 진단 시 크기가 크고 진행된 경우가 많다. 따라서, 이번 증례에서처럼 비특이적인 증상을 호소하여 시행한 상부위장관 내시경검사에서 우연히 발견된 상피하 종양의 검사 및 치료 중 진단될 수 있다. 내시경검사 및 내시경초음파검사는 상피하 종양의 형태로 관찰되는 위장관 평활근육종의 진단에서 반드시 필요한 검사이나 악성 위장관 간질종양과 차이점이 없어 감별이 불가능하다
[7]
. 이번 증례에서도 병변은 상부위장관내시경검사에서 표면 점막이 정상인 전형적인 상피하 종양으로 관찰되었으며, 내시경초음파검사는 위의 외부 근육층에서 유래하여 강외로 커지는 형태 및 비교적 큰 크기(4.0×4.0 cm), 내부의 비균질성 저에코 및 낭성 변화를 보여 악성 위장관 간질종양으로 의심하여 수술적 절제를 시행한 경우이다.
복부 CT는 복강 및 골반강의 육종의 병기 평가에서 필수적인 검사이며 복강 내 전이성병변을 평가하는 데 사용된다. 위장관 평활근육종의 CT소견은 크고 불균등한 위의 종양이 강외로 자라는 양상으로 관찰되며 궤양이 동반되기도 한다
[8]
. 하지만 이러한 CT소견은 내시경검사처럼 위의 악성 위장관 간질종양과 구별이 되지 않는 소견으로 진단에는 결정적인 단서를 제공하지 못한다. 따라서, 영상의학적 검사에서 림프절 및 원격전이가 없고, 내시경초음파검사에서 악성 위장관 간질종양과 감별이 어렵다면 수술적 절제로 확진 및 치료하는 것이 타당하다.
평활근육종의 전이는 주로 혈행성으로 이루어지며 대부분 폐와 간으로 전이가 되는데, 위장관에서 발생하는 평활근육종은 간이나 복막으로 우선 전이가 되므로 추적 관찰 시 복부 CT검사가 유용하다. 하지만 재발이 의심된 병변의 조직검사가 없는 상태에서 같은 암의 재발로 진단하기는 쉽지 않다. 이번 증례에서는 위에서 발생한 평활근육종의 완전 절제 후 동일한 위치에서 같은 성상의 상피하 종양이 발생하였고, 복부 CT의 간병변이 다발성으로 조영 전 영상에서 저음영을 보이고 조영제 주입 시에 상대적인 조영 감소를 보이는 전형적인 악성 종양의 간전이에 합당한 소견을 나타내어 원발 종양의 국소 재발 및 원격 전이로 진단함에 임상적으로 어려움이 없었다.
위에 발생한 평활근육종의 수술적 치료는 부분 위절제술 혹은 B복강경 쐐기 절제술로 충분하며 림프절 전이는 드물어 림프절 절제술은 일상적으로 시행하지 않는다
[1]
. 근치적 절제 후 5년 생존률은 18-50% 정도로 보고되고 있다
[9]
. 종양의 크기 및 위치에 따라서, 혹은 전이성병변이 있는지에 따라서 병기를 분류한다. 진단 당시의 병기와 함께 평활근육종의 조직학적 등급(histological grade)이 가장 중요한 예후인자인데, 세포 충실성(cellularity), 분화도, 핵다형성, 유사분열의 수 및 괴사의 존재 여부 등이 등급 판정에 주로 이용되며, 일부 연구자들은 조직의 괴사 유무 단독 혹은 조직의 괴사와 유사분열의 수에 따라 분류하기도 한다
[10]
. 이번 증례에서는 진단 당시 림프절 및 원격 전이가 없어 병기가 낮고, 수술을 시행하여 원발병소를 완전 절제하였으나, 조직학적 검사에서는 고등급의 평활근육종을 시사하는 소견(조직 내부의 괴사소견과 뚜렷한 핵다형성)이 관찰되었다. 완전 절제 후 비교적 빠른 시기에 수술부위의 국소재발 및 다발성 원격 전이가 발생한 점을 고려할 때 위에 발생한 평활근육종은 진단 당시 병기에 상관없이 수술 후 철저한 추적 관찰이 필요하고, 특히 조직학적 등급에 따라 추적 관찰 시기를 조절하는 것이 중요하다. 또한 향후 면역조직화학검사를 통해 확진된 위의 진성 평활근육종 환자들의 예후 인자 분석이 필요할 것으로 생각한다.
항암화학요법은 이번 증례와 같이 원격 전이가 동반된 경우 주로 시행되는데 doxorubicin, ifosfamide, dacarbazine의 병합요법이 주로 이용된다[11,12]. 방사선요법은 두경부 및 후복강에서 발생하는 연부조직종양에서는 충분한 변연을 가지고 제거하기가 어려워서 국소 치료의 성공률을 높이기 위해서 수술과 함께 종종 시행되지만 위장관 평활근육종에서의 연구는 미흡한 실정이다
[13]
.
위에서 발생하는 평활근육종은 위에서 발생하는 전체 악성 종양 중 약 1%에 불과한 매우 드문 종양이다. 면역조직화학법의 발달로 과거에 평활근육종으로 생각하던 병변들이 대부분 악성 위장관 간질종양으로 진단되어, 면역조직화학법을 통해 진성 위 평활근육종으로 확진한 증례를 찾기 힘들다. 치료 후 추적 관찰에 대한 지침은 매우 부족한데 이번 증례에서처럼 단일 병변으로 발견된 평활 근육종에서도 완전 절제 후 비교적 빠른 시기에 국소 재발 및 원격 전이가 발생할 수 있으므로, 수술적 치료 후에도 진단 당시의 병기와 완전절제 유무에 관계없이 지속적인 감시가 요구되며, 조직학적 검사에서 고등급으로 판정되는 경우 추적 내시경검사와 복부 CT검사를 적극적으로 시행하는 것이 필요하겠다. 저자들은 79세 남자 환자에서 위체부에 발생한 상피하 종양의 수술적 절제 후 조직학적 검사에서 위 평활근육종을 진단하였고, 완전 절제 후 1년 뒤 국소 재발 및 다발성 간전이 1예를 경험하여 문헌 고찰과 함께 보고한다. |
|

|
FIGURES
|

|
|

|
Fig.1
Endoscopic and EUS findings. (A) About 5 cm sized round protruding lesion with normal-appearing mucosa is noted on the posterior wall of the gastric body. (B) A relatively well-demarcated, 4.6×4.2 cm in diameter, heterogenous hypoechoic mass with lobuated contour and cystic change is noted. |

|
|
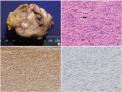
Fig.2
Pathologic findings. (A) The mass is grayish white and round with irregular nodular surface. (B) The mitosis is not infrequent. Arrow indicates bizarre mitotic figure (H&E, ×200). (C) The smooth muscle actin is strongly expressed (Immunohistochemical stain, ×200). (D) The c-kit is not expressed (Immunohistochemical stain, ×200). |

|

|
Fig.3
Endoscopic findings and radiologic findings after one year. (A) About 3.0 cm sized round subepithelial lesion with central umbilication is noted on the posterior wall of the gastric body. (B) There are multiple low attenuation masses on both lobes of the liver, compatible with typical liver metastasis. (C) Multiple increased metabolic liver masses are noted in both lobes of the liver. |

|
|
| |

|
REFERENCE
|

|
|
|
1.
|
Cormier JN, Pollock RE. Soft tissue sarcomas. CA Cancer J Clin 2004;54: 94-109. |
|
2.
|
Ishii T, Kuyama Y, Obara M, Yamanaka M, Imamura T. Gastrointestinal stromal tumor of the stomach. Intern Med 1997;36:392-7. |
|
3.
|
McLeod AJ, Zornoza J, Shirkhoda A. Leiomyosarcoma: computed tomographic findings. Radiology 1984;152:133-6. |
|
4.
|
Yeo WC, Lee GS, Kim BI, Lim HS, Hong JM, You KJ, et al. Two cases of leiomyosarcoma in stomach. Korean J Gastrointest Endosc 2000;21:633-7. |
|
5.
|
Song HJ, Lee DS, Yu SC, Kim JH, Song CW, Kim SW, et al. A case of gastric leiomyosarcoma with bleeding. Korean J Gastrointest Endosc 1998; 18:745-9. |
|
6.
|
Park SW, Ok CH, Chang YK, Lee SC, Park MI, Park SJ, et al. A case of gastric leiomyosarcoma associated with hypoglycemia. Korean J Gastroenterol 2000;35:111-5. |
|
7.
|
Hunt GC, Rader AE, Faigel DO. A comparison of EUS features between CD-117 positive GI stromal tumors and CD-117 negative GI spindle cell tumors. Gastrointest Endosc 2003;57:469-74. |
|
8.
|
Pannu HK, Hruban RH, Fishman EK. CT of gastric leiomyosarcoma: patterns of involvement. AJR Am J Roentgenol 1999;173:369-73. |
|
9.
|
Wile AG, Evans HL, Romsdahl MM. Leiomyosarcoma of soft tissue: a clinicopathologic study. Cancer 1981;48:1022-32. |
|
10.
|
Chou FF, Eng HL, Sheen-Chen SM. Smooth muscle tumors of the gastrointestinal tract: analysis of prognostic factors. Surgery 1996;119:171-7. |
|
11.
|
von Mehren M. New therapeutic strategies for soft tissue sarcomas. Curr Treat Options Oncol 2003;4:441-51. |
|
12.
|
Casali PG, Picci P. Adjuvant chemotherapy for soft tissue sarcoma. Curr Opin Oncol 2005;17:361-5. |
|
13.
|
Strander H, Turesson I, Cavallin-St?hl E. A systematic overview of radiation therapy effects in soft tissue sarcomas. Acta Oncol 2003;42:516-31. |
|
|
|