서 론
의학의 발달 및 경제의 발전, 그리고 개개인의 적극적인 생활방식의 개선으로 인하여 인간의 수명은 급격히 증가하게 되었다. 인간의 수명이 증가함에 따라 다양한 질병에 이환될 확률이 높아졌고, 고령에 호발하는 암의 특성상 고령의 암 환자 또한 지속적으로 증가하게 되었다[1]. 여러 암종 중에 위암은 우리나라에서 가장 흔히 발생하는 암 중 하나이며, 암 관련 사망의 4위를 차지하는 중요한 암종이다[2]. 2019년도 대한위암학회에서는 전국의 위암수술을 받은 환자들을 조사하였는데, 연구결과에 따르면 위암 환자의 진단 당시 평균 나이는 62.9세였다. 이 중 70세 이상의 고령 환자는 28.8%였고, 1995년(9.1%)과 비교했을 때 급격히 증가하고 있는 상태이다[3]. 위암의 가장 중요한 치료는 수술적 치료이다[4,5]. 이는 고령의 위암 환자에서도 마찬가지로 적용이 된다. 결과적으로 고령의 환자에서 수술적 치료를 받아야 하는 환자들 또한 지속적으로 증가하는 추세이기 때문에, 고령의 환자들을 대상으로 한 위암수술의 중요성은 점점 더 증가하고 있다.
일반적으로 고령의 환자들은 주요 장기의 기능이 저하되어 있고, 물리적인 스트레스에 대한 반응능력이 감소되어 있기 때문에 수술의 고위험군으로 알려져 있다[6]. 또한 오래 전의 연구들에서는 고령의 환자들이 고혈압, 당뇨병, 뇌졸중, 만성폐쇄성 폐질환 등의 질환을 동반하고 있는 경우가 많고, 이와 같은 동반된 질환들은 수술 후 회복에 많은 영향을 미치는 요인으로 작용하여 고령 환자의 위암수술은 젊은 환자들에 비해 재원일수의 증가, 합병증 발생 및 사망률 증가의 위험이 높다고 보고하였다[7,8].
하지만 최근에 고령의 위암 환자들을 대상으로 수술 후 합병증 발생에 대한 몇몇의 연구들이 진행되었는데, 일부의 연구결과들은 고령의 위암 환자의 수술 후 문합부 누출 및 합병증이 유의하게 높기 때문에 고령 환자의 수술 결정에 신중해야 된다고 주장하는 반면[9,10], 다른 연구들에서는 고령의 환자라도 위암수술 후 합병증은 젊은 환자들과 차이가 없어 적극적으로 시행해야 된다고 주장한다[11-13]. 이와 같이 고령 위암 환자에서 위절제술을 시행했을 때 젊은 환자들에 비해 합병증 발생이 증가하는지 여부에 대해 명확한 결론을 내릴 수 없는 상태이다. 이에 저자들은 단일기관의 데이터를 통하여 근치적 위절제술을 받은 고령 위암 환자들의 임상병리적 특성 및 수술결과들을 살펴보고자 한다. 또한 고령의 위암 환자에서 근치적 위절제술을 받았을 때 중대합병증(severe complications) 발생의 위험인자를 분석하고자 하였다.
대상 및 방법
1. 대상 환자 및 자료수집
2016년 1월부터 2019년 12월까지 4년간 순천향대학교 부천병원 외과에서 위암으로 진단받은 환자들 중 근치적 위절제술을 받은 환자들의 의무기록을 후향적으로 분석하였다. 순천향대학교 부천병원 임상연구윤리심의위원회의 승인하에 이루어졌고(2021-11-016), 후향적 의무기록 연구로 환자들의 informed consent는 생략되었다. 모든 환자는 상부 내시경검사를 받았고, 수술 전 조직검사에서 위선암이 확인되었다. 모든 환자에 대해 병기 결정을 위한 복부 컴퓨터 단층촬영을 시행하였고, 그 결과 원격전이가 있던 환자들은 연구대상에서 제외하였다. 최종적으로 514명의 환자가 본 연구에 포함되어 이들의 자료를 분석하였다. 의무기록조사에는 성별, 나이 등의 인구통계학적 자료와 키, 체중, 체질량지수, 동반질환 등의 임상적 지표를 포함하였고, 종양의 조직학적 분화도 및 종양의 크기, 위벽의 침범 깊이, 림프절 전이 여부 등의 병리학적인 지표들도 포함하였다. 또한 수술방법, 위의 절제범위, 림프절 절제범위, 동반절제 여부, 수술시간, 절제된 림프절 개수, 출혈량 등의 수술 관련 지표 및 수술 후 재원일수, 전체 합병증의 발생 유무, 중대합병증의 발생 유무 및 수술 후 사망 여부 등 수술 후 회복과 연관된 지표들도 조사되었다. 병리적인 병기는 미국 암연합위원회(American Joint Committee on Cancer)의 병기 분류방식에 따라 결정되었다[14]. 대상 환자들을 69세 이하의 젊은 환자군(younger group, n=369)과 70세 이상의 고령 환자군(elderly group, n=145)으로 나누어 임상적, 병리적 특성 및 수술결과 지표를 확인하였고, 두 군의 차이점에 대한 통계적 분석을 하였다. 또한 고령의 환자들에서 중대합병증 발생에 영향을 미치는 위험인자들에 대한 분석도 시행하였다.
2. 합병증의 진단 및 분류
합병증은 수술 후 정상적인 회복과정에서 벗어난 경우로 정의하며, 외과수술의 합병증 분류방법인 클라비엔과 딘도의 분류(Clavien-Dindo classification)에 따라 합병증의 정도를 결정하였다[15]. 클라비엔과 딘도의 분류체계에서는 합병증이 발생했을 때 어떤 처치를 하는지에 따라 합병증 정도가 결정된다. 합병증 1단계(grade 1)는 발열 시 해열제를 투여하거나 상처에 삼출물이 생겨 추가적인 소독을 하는 경우와 같이 침상 옆에서의 처치(bedside procedure)가 시행된 경우가 해당되고, 합병증 2단계(grade 2)는 항생제를 사용하거나 수혈을 하는 등의 약물치료가 시행된 경우가 이에 해당한다. 합병증 3단계 초기(grade 3a)는 복강 내 농양에 대한 경피적 배액관 삽입술(percutaneous catheter drainage) 혹은 문합부 협착 등에 대한 내시경적 풍선확장술(endoscopic balloon dilatation)과 같이 국소마취하의 치료적 시술이 행해졌을 때, 3단계 후기(grade 3b)는 전신마취하 시행된 추가적인 수술 등이 이에 해당한다. 합병증 4단계(grade 4)는 2군데 이상의 다발성 장기 손상으로 중환자실 치료를 받을 때가 이에 해당된다[15]. 중대합병증이란 3단계 이상의 합병증으로 정의되며, 침습적인 처치를 해야만 해결이 가능한 합병증을 일컫는다. 수술 후 퇴원하지 못하고 사망한 경우 및 퇴원을 한 경우라도 수술로부터 30일 이내에 사망한 경우 수술 후 사망으로 간주하였다.
3. 통계적 방법
나이에 따른 두 군의 임상적, 병리적 지표 및 수술 및 회복과 관련된 지표 중 연속형 변수는 평균과 표준편차로 나타냈으며, 범주형 변수는 빈도와 비율(%)로 나타냈다. 두 군의 차이에 대한 유의성 검정에는 연속형 변수의 경우 Student t-검정을 수행하였으며, 범주형 변수의 경우 카이제곱검정(chi-square test)을 수행하였다. 여러 임상적, 병리적 변수 및 수술연관 변수들과 중대합병증에 대한 승산비(odds ratio)의 경우 단변량 로지스틱회귀분석(logistic regression analysis)을 통하여 산출하였으며, 군별로 통계적으로 유의한 차이를 보였거나 이 근사치(0.1 미만)의 P값을 가지는 변수들을 포함하여 다변량 로지스틱회귀분석을 시행하였다. 모든 통계분석은 IBM SPSS ver. 26.0 for Windows (IBM Corp., Armonk, NY, USA)을 이용하였다. 분석결과 P값이 0.05 미만인 경우 통계학적으로 유의하다고 판정하였다.
결 과
1. 대상 환자들의 연령 분포 및 고령 환자의 임상병리적 특성
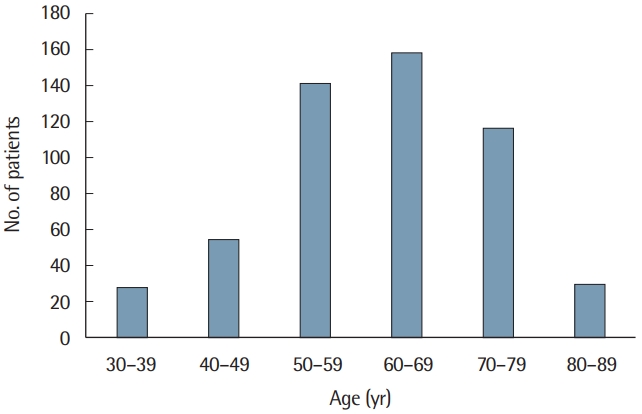
대상 환자 514명 중 50대와 60대에서 가장 많은 분포를 보였고, 80대의 환자들도 29명(5.6%)이 있었다(Fig. 1). 대상 환자들 중 70세 이상의 고령 환자군(elderly group)은 145명으로 전체 환자의 28.2%가 이에 해당되었다. 고령 환자군의 평균 나이는 76.3±4.2세였고, 남자 환자의 비율이 72.9%였으며, 평균 체질량지수는 23.9±3.5 kg/m2였다. 이들의 평균 종양 크기는 4.0± 3.5 cm였고, 조기위암이 53.1%, 림프절 전이가 없는 비율이 62.8%였다.
젊은 환자군(younger group)과 비교했을 때, 고령 환자군에서 동반질환에 이환된 비율이 높았으며(P< 0.001), 조직학적으로 고분화암의 비율이 높았다(P= 0.006). 종양의 크기는 두 군에서 차이가 없었으나, 종양의 위벽 침범 깊이가 고령 환자군에서 더 깊었고(P= 0.012), 림프절 전이 또한 더 흔하였다(P= 0.006). 남녀 분포 및 체질량지수는 두 군에서 유의한 차이가 없었다(Table 1).
2. 고령 환자의 수술결과
70세 이상의 고령 환자 145명에서 진행된 위절제수술 중 77.2%에서 최소침습수술이 이루어졌고, 개복수술이 진행된 경우는 22.8%였다. 고령 환자의 76.6%에서 대부분 위절제술(subtotal gastrectomy)이 시행되었고, D2 범위 이상의 림프절 절제술이 시행된 경우가 81.3%였다. 고령 환자들의 평균 수술시간은 151.2± 67.8분이었고, 평균 출혈량은 181.5±178.5 mL였으며, 수술 후 평균 재원일수는 9.5±4.4일이었다. 고령 환자의 24.1%에서 합병증이 발생하였고, 3단계 이상의 합병증인 중대합병증은 7.6%의 환자에서 발생하였다. 총 145명의 고령 환자 중 2명에서 수술 후 사망이 있었고, 전체의 1.4%가 이에 해당되었다.
젊은 환자군과 비교했을 때, 70세 이상의 고령 환자군에서 개복하여 수술을 진행한 비율이 높았으나, 통계적 유의성은 없었다(P=0.085). 위의 절제범위 및 림프절 절제범위, 수술시간 및 출혈량, 수술 후 재원일수, 절제된 림프절 개수에서도 양 군 간의 유의한 차이는 보이지 않았다. 하지만 수술 후 전체 합병증(P= 0.046) 및 중대합병증(P= 0.049)의 경우 통계적으로 유의하게 고령 환자군에서 더 높았다(Table 2). 양 군에서 각각 두 명의 수술 후 사망 환자가 있었는데, 통계적인 차이는 없었다.
3. 고령 환자에서 중대합병증과 연관된 인자들의 분석
고령 환자에서 단변량 회귀분석결과 전체 위절제술(total gastrectomy)을 시행했을 때 유의하게 중대합병증 발생이 증가하였고(P= 0.018), 남자 환자의 경우(P= 0.056) 및 개복수술을 했을 때(P= 0.073) 통계적으로 유의하지는 않았으나 근사치의 P값을 보였다. 이 외에 체질량지수, 동반질환, 종양의 크기, 림프절 절제범위, 조직학적 분화도, 종양의 깊이, 림프절 전이 여부, 수술시간 및 출혈량은 중대합병증의 발생과 연관성이 없었다. 통계적으로 유의성이 있었던 인자인 위 절제범위와 근사치의 P값을 보였던 성별, 수술방법을 변수로 하여 다변량 회귀분석을 시행했을 때, 전체 위절제술을 시행한 경우 대부분 위절제술을 시행했을 때보다 통계적으로 유의하게 중대합병증 발생의 위험이 증가하는 것으로 분석되었다(P= 0.044) (Table 3).
고 찰
본 연구에서 70세 이상의 고령 위암 환자에서 합병증(16.5% versus 24.1%, P= 0.046) 및 중대합병증(3.5% vs. 7.6%, P= 0.049) 발생의 비율은 젊은 환자에 비해 통계적으로 유의하게 높았다. 고령의 환자들은 전신마취하 수술의 고위험군으로 알려져 있는데, 이는 나이가 많아질수록 고혈압, 당뇨, 천식, 뇌혈관질환과 같은 만성질환에 이환되어 있는 경우가 많고, 영양상태도 불량한 경우가 많으며, 인지능력 또한 감소되어 있는 경우가 많았기 때문이다[6,16]. 본 연구에서도 고령의 환자군에서 합병증 발생 및 중대합병증 발생이 젊은 환자군에 비해 더 높았고, 이는 과거의 연구결과와 부합한다[17,18]. 고령의 환자군에서 젊은 환자군에 비해 종양의 침범 깊이가 더 깊었고, 림프절 전이가 더 흔했다. 다시 말해서 고령 환자들은 위암의 진행이 더 많이 된 상태에서 진단이 된 것으로 판단되며, 이 결과는 70대 이상의 고령 환자군에서 60대 이하의 젊은 환자들보다 정기적인 건강검진을 적극적으로 시행하지 않음으로써 위암의 발견이 늦어져 생긴 결과로 유추해볼 수 있다. 본 연구에서는 또한 고령의 환자들은 젊은 환자들에 비해 동반질환이 월등히 많았는데(59.6% vs. 82.8%, P< 0.001), 이런 상황에서도 수술은 젊은 환자들과 다름없이 표준수술이 진행되었다. 실제로 본 연구결과, 최소침습수술의 방법, 위 절제범위, 림프절 절제범위, 비장이나 췌장 등의 주위장기 동반절제 여부, 수술시간 및 출혈량 등은 두 군에서 차이가 없었다. 이 결과는 고령 환자에서도 수술의 질(quality)은 젊은 환자들과 동일했다는 것을 의미한다. 위암의 완치를 위한 가장 중요한 치료방법이 수술인데, 근치적 위암수술을 위해서는 충분한 위 절제와 림프절 절제가 필수적이다. 따라서 고령의 환자에서도 완치를 목적으로 하는 근치적 위암수술이 진행될 때, 위 절제 및 림프절 절제, 주위 장기 침범 시 동반 절제 등 표준수술이 철저하게 이루어지고 있음을 의미하여, 수술을 통하여 젊은 환자들과 같은 완치의 기회를 얻을 수 있다는 점에서 중요한 의미를 가진다고 하겠다.
본 연구에서 고령 환자들의 중대합병증 발생에 독립적으로 유의한 영향을 미치는 인자로 전체 위절제술(P= 0.044)이 확인되었다. 이 분석결과는 이전의 연구결과들과 일치하고 있다[18-21]. 전체 위절제술은 대부분 위절제술과 비교했을 때, 수술시간이 더 길고 수술 중 출혈량이 더 많다[18,19]. 또한 림프절 절제범위가 위 상부까지 포함되어 수술 중 다뤄지는 범위가 대부분 위절제술에 비해 크며, 식도와 소장 연결부위의 누출이 발생했을 때 직접적으로 종격동 및 폐에 영향을 주어 중대합병증으로 진행하는 경우가 흔하다. 따라서 고령의 환자에서 전체 위절제술이 예정되어 있을 때보다 더 세심한 수술 전 준비 및 수술 후 관리가 필요하다고 하겠다.
본 연구에서는 70세 이상의 환자들을 고령 환자군으로 분류하였다. 실제로 고령(old age or elderly)의 정의는 명확히 정해진 바는 없으며, 문헌들마다 연구자들이 기준을 나누어 정의 및 분류하여 연구를 진행하고 있다. 이론적으로는 세계보건기구(World Health Organization)에서 65세 이상의 나이를 고령으로 정의하고 있지만, 현재 대부분의 임상의사들은 65세의 나이를 고령으로 분류하는데에 동의하지 않고 있다. 본 연구에서는 대상 환자들의 수술 당시 나이가 30세에서 89세까지 분포하고 있었는데, 80대 환자들의 수가 29명으로 너무 적어 고령을 대표하기에는 부족한 상황으로 판단하여 70대 및 80대 환자들을 고령으로 분류하였다. 또한 본 연구에서는 고령의 환자들을 대상으로 전체 합병증 대신 중대합병증 발생의 위험인자를 분석하였다. 중대합병증은 합병증 단계 3 이상의 합병증으로, 이는 내시경적 처치(grade 3a), 방사선 중재하 시술(grade 3a) 혹은 전신마취하 재수술(grade 3b) 등의 침습적인 치료가 필요한 합병증과 다발성 장기 부전으로 중환자실에 입실(grade 4)하여 적극적인 중환자관리(critical care)가 필요한 합병증이 이에 해당되며, 침상 옆 처치(grade 1) 혹은 약물치료(grade 2)와 같은 일반적인 처치만을 필요로 하는 합병증과는 구별이 된다. 따라서 중대합병증의 발생과 연관된 인자를 확인하는 것은 의의가 더 크다고 할 수 있다.
이 연구의 한계점은 첫째, 후향적 의무기록을 통한 연구라는 점이다. 후향적 연구의 속성상 잠재적인 선택 편향(selection bias)을 완전히 배제하기 어렵고, 환자들의 임상정보는 의무기록에 기반을 두고 있어 기록이 누락이 되었거나 잘못 기입된 정보들도 포함되어 있을 가능성이 있다. 둘째, 본 연구가 단일기관에서 이루어진 연구이며, 연구에 포함된 대상 환자 수가 충분하지 않은 제한점이 있다. 셋째, 본 연구에서 추적관찰 기간이 짧아 수술 후 재발률이나 생존율에 대한 분석을 시행하지 못했다는 점이다. 향후 전향적 다기관 연구를 통하여 자료수집을 보다 정밀하게 하고, 충분한 대상환자 수를 확보하여 장기 추적관찰 데이터를 포함한 종합적인 분석을 한다면 보다 더 신뢰할 수 있고 도움이 되는 결과를 도출할 수 있을 것이다.
결론적으로, 고령의 위암 환자들은 젊은 환자들보다 동반질환이 많았고, 전체 합병증 및 중대합병증 발생이 통계적으로 유의하게 많았다. 특히 고령 위암 환자에서 전체 위절제술을 받은 경우 중대합병증 발생위험이 대부분 위절제술을 받은 경우보다 3.7배 이상 더 높았다. 따라서 고령의 위암 환자들에게 근치적 위절제술을 시행하는 경우, 합병증 발생이 젊은 환자들에 비해 높음을 인지하고, 철저한 수술 전 준비 및 수술 후 관리가 필요할 것이며, 특히 전체 위절제술을 시행해야 되는 경우에는 더욱더 주의를 기울여야 하겠다.