Henoch-Schönlein 신염의 예측인자로서 Neutrophil-Lymphocyte Ratio의 유용성에 대한 연구
Clinical Usefulness of Neutrophil-Lymphocyte Ratio as a Predictor of Henoch–Schönlein Nephritis
Article information
Trans Abstract
Objective
Henoch–Schönlein purpura is the most widespread systemic vasculitis during childhood. This study evaluated the relationship between neutrophil-lymphocyte ratio (NLR) and Henoch–Schönlein nephritis, which is important for the long-term prognosis of Henoch–Schönlein purpura.
Methods
We retrospectively reviewed patients diagnosed with Henoch–Schönlein purpura at the Department of Pediatrics of Soonchunhyang University Bucheon Hospital between January 2007 and June 2018. One hundred and twelve patients under the age of 18 who were diagnosed with Henoch–Schönlein purpura according to Henoch–Schönlein purpura diagnostic criteria, European League Against Rheumatism were included in the study. Blood and urine test, gastroscopy and colonoscopy, and abdominal computed tomography performed during the first visit were included.
Results
Among 112 Henoch–Schönlein purpura patients, 25 patients were Henoch–Schönlein nephritis. NLR was significantly increased in patients with Henoch–Schönlein nephritis compared to patients without nephritis (P=0.042), which is an independent predictor of Henoch–Schönlein nephritis.
Conclusion
This study showed that NLR could be a useful predictor of Henoch–Schönlein nephritis in patients with Henoch–Schönlein purpura.
서 론
Henoch–Schönlein 자반증은 청소년기에 가장 흔한 전신성 혈관염으로 자반성 발진과 동반된 관절통, 두통, 복통, 위장관 출혈, 혈뇨, 단백뇨 등의 다양한 임상증상을 보이는 질환으로 아직 정확한 원인은 확실하지 않으나 약 50%의 환자에서 상기도 감염이 선행된다. 자반은 질병의 경과 중 가장 흔한 증상으로 특징적으로 종아리, 엉덩이에 나타나지만 팔이나 얼굴, 몸통에도 나타날 수 있고 20%–46%에서 손, 발, 두피, 귀 등의 부종을 동반한다[1]. 관절증상은 두 번째로 흔한 증상으로 관절통이나 관절염으로 나타나며 주로 중력의 영향을 받는 무릎이나 발목에 발생되는데, 손이나 발에도 생길 수 있으며 질병의 경과 중 60%–84%에서 발생한다. 관절염은 한시적으로 발생하여 시간이 지남에 따라 저절로 호전되는 임상양상을 보이지만 통증이 심해서 거동을 못하게 되는 경우도 종종 있으나 영구적인 관절장애를 동반하지 않는다. 위장관계 증상은 세 번째로 흔한 증상으로 복통은 특징적으로 급성 경련복통으로 나타나고 구토, 변비, 설사 등을 동반한다. 50%–75%의 환아에서 복통, 구토, 위장관 출혈 등을 주 증상으로 하는 위장관계 증상을 보이고 30%의 환아에서 잠혈 혹은 대량 혈변이 동반되며 1%–5%의 환아에서 장중첩을 보인다. 상부위장관 내시경검사 시 위, 십이지장 등에서 출혈성, 미란성 염증소견을 보인다[2]. 또한 40%–50% 환자에서 질병의 경과 중 신장 침범을 보이고 대개 초기 임상증상 발현 4–6주 이내에발생한다. Henoch–Schönlein 자반증에 동반되는 신염은 일시적인 현미경적 혈뇨부터 급속하게 진행되는 신염까지 다양하게 나타날 수 있으며 신장 침범을 보이는 거의 모든 환자에서 혈뇨를 보이나 단백뇨나 신증후군, 고혈압 등은 흔하지 않다. 혈뇨와 단백뇨가 동반된 환자의 15%에서 만성신부전으로 진행하고 신증후군과 신기능 저하가 동반된 환자의 50%에서 만성신부전으로 진행한다[1,3]. 병의 경과는 대체로 양호하며 병의 지속기간은 대개 4–5주 정도이나 환자에 따라서 재발을 반복하여 수개월 혹은 그 이상 지속되는 경우도 있으며 신 침범 여부가 예후에 가장 중요하고 드물게 신부전까지 될 수 있는데, 이는 Henoch–Schönlein 자반증의 예후에 가장 중요하다.
Henoch–Schönlein 자반증의 예후에 영향을 주는 초기 임상증상 및 위장관 출혈 또는 신장 침범을 예측할 수 있는 임상적 소견 또는 검사소견에 대한 많은 연구가 있었고, 백혈구 증가, 혈소판 증가, C반응 단백질(C-reactive protein, CRP)의 상승 등이 Henoch–Schönlein 자반증의 증상의 정도나 위장관계 침범과 관계가 있다고 보고되었다[4,5].
적혈구 분포폭(red blood cell distribution width, RDW)은 순환하는 적혈구 크기의 다양성을 반영하는 것으로 RDW 값이 높을수록 변동성이 크다는 것이며 적혈구 파괴의 증가 혹은 비효율적인 적혈구의 생산을 의미하고 전신성 염증, 영양 부족, 신기능 장애와 같은 요소들이 적혈구의 항상성을 변화시키게 된다. RDW의 상승은 패혈증, 패혈성 쇼크, 뇌졸중 및 심부전 등에서 불리한 예후인자로 밝혀졌고, 염증성 장 질환, 베체트병 및 전신성 홍반성 루푸스 등에서의 질병의 활성도를 평가하기 위한 척도로 사용되며 다른 염증매개변수인 CRP, 적혈구침강속도(erythrocyte sedimentation rate, ESR), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α) 등과 상관관계를 보인다. Xu 등[6]의 연구에서 적혈구의 크기 분포를 반영하는 RDW가 Henoch–Schönlein 신염 환자에서 독립적인 예측인자로 보고된바 있다.
최근 여러 질병에서 초기 급성 반응의 지표로서 호중구-림프구비(neutrophil-lymphocyte ratio, NLR), 혈소판-림프구 비(platelet lymphocyte ratio, PLR)의 유용성에 대한 연구가 이루어지고 있다. 호중구는 염증 및 감염에 증가하며 림프구는 면역조절세포로 쇼크나 패혈증에서 세포자멸에 의해 감소한다[7]. 호중구 수의 증가 및 림프구 수의 감소는 다양한 감염질환 및 전신의 염증, 스트레스에 의한 비감염성 질환에서 흔하게 보인다. 심혈관계 질환, 악성종양, 낭포성 섬유증, 가족성 지중해열 등에서 예후를 예측하는 예측인자로서 NLR의 유용성이 입증되었고[8-13], 급성기 반응의 지표로서 건선 및 류마티스성 관절염과 같은 질병에서 유용성이 입증되었다[14,15]. 혈소판 또한 호중구와 유사하게 염증성 질환의 활동에 중요한 역할을 하는 시토카인을 생성하며 NLR와 마찬가지로 PLR도 특정 질환에서 염증의 지표로 사용되고 있다. 특정 악성종양 및 만성질환에서 임상적 및 병리학적 특성과 PLR의 상관관계가 밝혀졌고[16-18], 말초동맥질환 및 허혈에서 PLR의 상승을 보였다[19]. Uslu 등[13]은 류마티스 관절염 환자에서 질환의 중증도와 PLR 사이에 상관관계가 있다고 하였으며, Wu 등[20]은 전신성 홍반성 루푸스의중증도와 PLR 사이에 상관관계가 있다고 보고하였다.
Henoch–Schönlein 자반증에서는 Makay 등[21]에 의해 처음으로 소아에서 위장관 출혈과 NLR의 연관성이 보고되었고, Park 등[22]에 의해 성인에서 위장관 출혈과 NLR의 연관성이 보고되었다. 한편, Gayret 등[23]의 연구에서 위장관 출혈 환자에서 PLR가 통계적으로 유의하게 증가하였으나 NLR는 유의한 차이를 보이지 않았다.
하지만 소아 Henoch–Schönlein 자반증의 예후에 중요한 Henoch–Schönlein 신염과 관련있는 예측인자에 대해서는 보고된 바가 없어 본 연구에서는 NLR, PLR 등과 Henoch–Schönlein 신염과의 연관성에 대해 연구하고자 한다.
대상 및 방법
1. 연구대상 및 연구 방법
2007년 1월부터 2018년 6월까지 순천향대학교 부천병원 소아청소년과에 내원하여 Henoch–Schönlein 자반증으로 진단받은 18세 미만의 환자 112명을 대상으로 하였고 Henoch–Schönlein 자반증의 진단기준 European League Against Rheumatism [24]에 따라 자반이 나타나면서 복통, 관절통, 신 침범증상, 신 생검상에서 immunoglobulin A (IgA) 침착의 관찰 중 최소 한가지 이상이 동반 될 때 Henoch–Schönlein 자반증으로 진단하였고 입원한 환자만을 포함하였다. 이 연구는 순천향대학교 부천병원 임상시험심사위원회의 승인을 받았고(IRB approval no., 2019-07-008), 후향적 연구이기 때문에 연구대상자들에 대한 동의는 면제되었다.
모든 대상 환자의 의무기록을 참고하여 성별과 진단되었을 때의 나이, 계절별 발생빈도, 선행 상기도 감염 유무, 주요 임상증상, 합병증 동반 여부에 대하여 후향적으로 조사하였고 임상증상은 피부증상, 관절증상, 두통, 위장관증상, 신장 침범으로 피부증상은 특징적인 자반 및 점상 출혈 등으로 정의하였고, 관절증상은 환자가 관절의 통증을 호소하거나 신체검사에서 압통이나 부종이 관찰될 때 관절염으로 정의하였다. 환자가 복통을 호소하거나 흑색변 혹은 혈변, 토혈이 동반될 때 위장관증상으로 정의하였고 신장 침범은 (1) 현미경적 혈뇨: >5 적혈구/고배율 시야, (2) 육안적 혈뇨: >1,500 적혈구/고배율시야, (3) 신증후군범위이하의단백뇨: 요단백 ≥ 0.15 g/일, ≤3.5 g/일 또는 ≥4 mg/m2/시간, ≤ 40 mg/m2/시간, (4) 신증후군 범위의 단백뇨: 요단백 >3.5 g/일 또는 >40 mg/m2/시간으로 정의하였다.
혈액검사소견 중 백혈구 수, 호중구 수, 림프구 수, 혈색소, 혈소판 수, 평균 적혈구 용적(mean corpuscular volume, MCV), RDW, 평균 혈소판 용적, ESR, CRP 등을 확인하였고 NLR과 PLR은 각각 호중구 수와 혈소판 수를 림프구 수로 나누어 구하였다.
2. 통계분석
연속변수는 평균±표준편차, 범주형 변수는 숫자(백분율)로 표시하였다. 통계분석은 PASW SPSS ver. 18.0 (SPSS Inc., Chicago, IL, USA)을 사용하여 독립 표본 t-검정을 시행하였고, 이항형 로지스틱 회귀분석을 시행하여 Henoch–Schönlein 신염의 독립적인 예측인자에 대해 알아보았다. Receiver operating characteristic (ROC) 곡선을 구하여 민감도 및 특이도가 가장 높은 cut-off를 구하였고 P 값이 0.05 미만인 경우 통계학적으로 유의하다고 판정하였다.
결 과
1. 발병양상
남아 57명, 여아 55명으로 남녀성비는 1.03:1이었고 평균 연령은 6.1± 0.7세였으며 Henoch–Schönlein 신염 환아의 평균 나이는 8.1세로 2–7세가 15명(60%), 8–11세가 5명(20%), 12–18세가 5명(20%)이었다(Table 1). 계절에 따른 발병률은 가을(37예, 33%), 봄(33예, 30%), 겨울(30예, 27%), 여름(12예, 10%)의 순으로 나타났다. Henoch–Schönlein 자반증 발병 4주 이내 상기도 감염은 69예(62%)에서 관찰되었으며, 그 외 알레르기 과거력이 있는 환아는 11예(10%)에서 관찰되었다.
2. 임상증상
모든 환아에서 점상 출혈 및 자반증이 발생하였고 111명(99%)에서 하지에 침범된 소견을 보였다(Table 2). 상지는 22명(19%), 몸통은 4명(3%), 둔부는 19명(17%), 기타 부위로 얼굴 및 생식기 침범이 10명(9%)에서 있었다. 관절증상은 84명(75%)에서 동반되었으며 그중 무릎이 38명(34%), 발목이 68명(60%)으로 주로 하지 관절통을 호소하였고 손목은 9명(8%)에서 통증을 호소하였다. 위장관증상은 72명(64%)에서 복통으로 나타났고, 이들 중 9명(8%)에서 위장관 출혈이 동반되어 흑색변(2예, 2%), 혈변(6예, 5%), 토혈(1예, 0.9%)로 나타났다. 상부 내시경검사는 7명(6%), 하부 내시경검사는 2명(2%), 복부 컴퓨터단층촬영은 1명(0.9%)에서 시행되었다. 상부 내시경 검사결과는 대부분이 출혈성 위염, 미란성 십이지장염, 미란성 위염을 보였고, 하부 내시경검사결과에서는 장점막의 염증성 변화만이 관찰되었다. 복부 컴퓨터단층촬영에서는 장벽의 부종, 염증성 변화가 보였다.
소변검사에서 혈뇨 또는 단백뇨를 보인 경우 신장 침범으로 정의하였고 25명(22%)에서 관찰되었다. 혈뇨를 보인 환자는 22명(19%)이며 그 중 현미경적 혈뇨가 18명(16%), 육안적 혈뇨가 4명(3%)에서 나타났다. 단백뇨를 보인 10명(8%)에서 신증후군 범위에 미치지 못하는 단백뇨가 4명(3%), 신증후군 범위의 단백뇨는 6명(5%)에서 관찰되었다.
3. Henoch-Schönlein 신염의 예측인자
1) 적혈구 분포폭
Henoch–Schönlein 신염 환자에서 신염이 동반되지 않은 환자에 비해 RDW가 유의하게 증가되어 있었고(P=0.032), 단변량 로지스틱회귀분석에서 RDW가 통계적으로 유의하게 증가하여 관련 있는 예측인자로 확인되었으나 다변량 로지스틱회귀분석에서는 유의한 차이를 보이지 않아 독립적인 예측인자의 가능성은 떨어진다(P=0.423) (Table 3).
2) 호중구-림프구 비
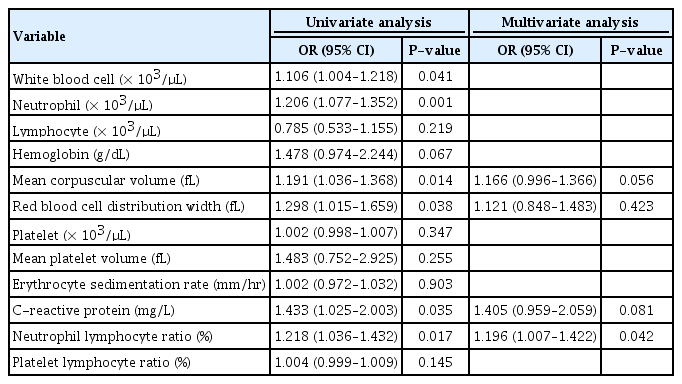
Henoch–Schönlein 자반증 환자 중 신염이 동반된 환자와 동반되지 않은 환자의 혈액검사소견을 비교하였고, NLR이 Henoch–Schönlein 신염 환자에서 신염이 동반되지 않은 환자에 비해 유의하게 증가되어 있었다(P=0.027) (Table 3). 또한 단변량 로지스틱회귀분석에서 NLR이 유의하게 증가하여 관련 있는 예측인자로 밝혀졌고(P = 0.017), 다변량 로지스틱회귀분석에서는 NLR만이 Henoch–Schönlein 신염의 독립적인 예측인자로 확인되었다(P = 0.042) (Table 4).
3) 혈소판-림프구 비
PLR은 Henoch–Schönlein 신염 환자와 신염이 동반되지 않은 환자 사이에 유의한 차이를 보이지 않았고(P=0.133) (Table 3), 단변량 로지스틱회귀분석에서도 통계적인 유의성을 확인하지 못하였다(P=0.145) (Table 4).
4) 그 외
Henoch–Schönlein 자반증 환자 중 신염이 동반된 환자와 동반되지 않은 환자의 혈액검사소견을 비교하였을 때 백혈구 수와 림프구 수, 혈소판 수는 Henoch–Schönlein 신염 환자들과 신염이 동반하지 않은 환자들 사이에 유의한 차이가 없었고(P=0.121, P=0.207, P=0.482), 호중구 수는 Henoch–Schönlein 신염 환자에서 신염이 동반되지 않은 환자에 비해 유의하게 증가되어 있었다(P=0.011) (Table 3).
또한 단변량 로지스틱회귀분석에서 NLR, RDW 외에도 백혈구(P=0.041), 호중구(P=0.001), MCV (P=0.014), CRP (P=0.035)가 유의하게 증가하여 관련 있는 예측인자로 밝혀졌으나 다변량 로지스틱회귀분석에서는 NLR 외 다른 혈액검사들은 Henoch–Schönlein 신염과 통계적으로 유의한 차이를 보이지 않아 독립적인 예측인자의 가능성은 떨어진다(Table 4).
5) 호중구-림프구 비의 cut-off 치
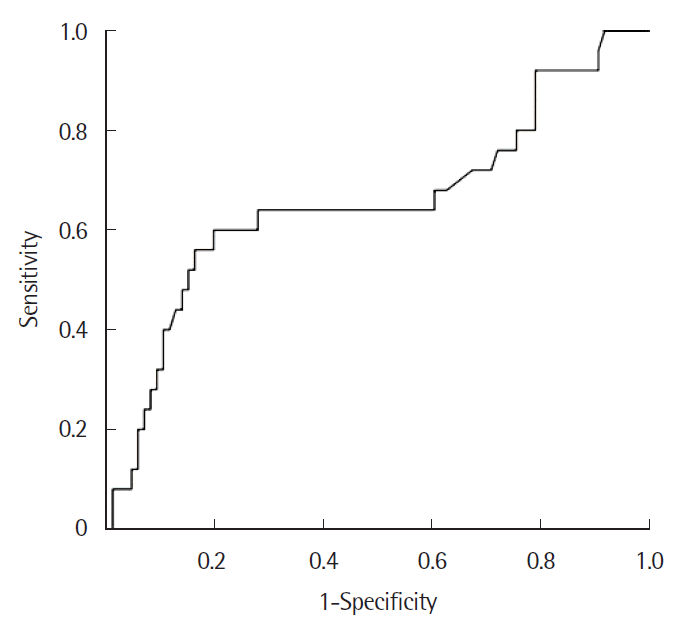
ROC 곡선을 통하여 NLR의 area under the curve (AUC)와 cut-off 치를 구하였고, ROC 곡선에서 NLR의 cut-off 치는 3.315였고 민감도와 특이도는 각각 60.0%와 80.5%였으며 AUC 값은 0.656이었다(Fig. 1).
고 찰
Henoch–Schönlein 자반증은 청소년기에 발생하는 가장 흔한 전신성 혈관염으로 조직학적으로 IgA가 소혈관에 침착되어 유발되는 백혈구 파쇄성 혈관염(leukocytoclastic vasculitis)이다. IL-1, IL-6 및 TNF-α와 같은 전염증성 시토카인이 과도하게 생산되어 작은 혈관의 염증 및 내피세포의 손상을 일으키며[25,26], 급성기에 보이는 소혈관 주위의 IgA의 침착, 다형핵 백혈구 침투, IgA와 염증성 시토카인의 증가는 Henoch–Schönlein 자반증이 특히 감염에 의해 유도되는 특정 면역매개 질환임을 시사한다.
Henoch–Schönlein 자반증의 중증도나 예후와 관련 있는 인자로 혈소판 증가, 백혈구 증가, CRP의 상승 등이 보고되었고[4,5], 적혈구의 크기 분포를 반영하는 RDW가 Henoch–Schönlein 신염 환자에서 독립적인 예측인자로 보고되었다. Xu 등[6]에 따르면 Henoch–Schönlein 신염 환자에서 신염이 동반되지 않은 환자에 비해 RDW가 유의하게 증가하여 RDW가 Henoch–Schönlein 신염의 독립적인 예측인자임을 알 수 있었다. RDW는 순환하는 적혈구 크기의 다양성을 반영하여 RDW 값이 높을수록 변동성이 크다는 것이며, 적혈구 파괴의 증가 혹은 비효율적인 적혈구의 생산을 의미하고, 전신성 염증, 영양 부족, 신기능 장애와 같은 요소들이 적혈구의 항상성을 변화시키게 된다. 최근 RDW의 상승은 패혈증, 패혈성 쇼크, 뇌졸중 및 심부전 등에서 불리한 예후인자로 밝혀졌고, 염증성 장질환, 베체트병 및 전신성 홍반성 루푸스 등에서의 질병의 활성도를 평가하기 위한 척도로 사용되며 다른 염증 매개변수인 CRP, ESR, IL-6, TNF-α 등과 상관관계를 보인다. Xu 등[6]의 연구에서 RDW의 상승과 Henoch–Schönlein 신염의 상관관계를 통계학적으로 증명하였고, Henoch–Schönlein 신염에서 콩팥 생검의 조직학적 소견에서 사구체 내의 반월체형성(crescents form)을 예측할 수 있는 RDW의 cut-off는 13.25였다. 본 연구에서도 Henoch–Schönlein 신염의 예측인자로서 RDW에 대한 통계학적인 분석을 시행하였고 Henoch–Schönlein 신염 환자에서 신염을 동반하지 않은 환자에 비해 RDW가 유의하게 증가되어 있었으나(P=0.032), 다변량 로지스틱회귀분석에서는 통계적인 유의성을 확인하지 못하였다(P=0.423).
최근 여러 질병에서 초기 급성 반응의 지표로서 NLR, PLR의 유용성에 대한 연구가 이루어지고 있다. 호중구는 염증 및 감염에 증가하며 림프구는 면역조절세포로 쇼크나 패혈증에서 세포자멸에 의해 감소한다[7]. 호중구 수의 증가 및 림프구 수의 감소는 다양한 감염질환 및 전신의 염증, 스트레스에 의한 비감염성 질환에서 흔하게 보인다. NLR은 호중구 수를 림프구 수로 나누어 구하며 초기 급성 반응의 지표로서 ESR 및 CRP와 마찬가지로 여러 질병에 있어 유용성에 대한 연구가 이루어지고 있다. 예를 들어, 심혈관계 질환, 악성종양, 낭포성 섬유증, 가족성 지중해열 등에서 예후를 예측하는 예측인자로서 NLR의 유용성이 입증되었고[8-13], 급성기 반응의 지표로서 건선 및 류마티스성 관절염과 같은 질병에서 유용성이 입증되었다[14,15]. 혈소판 또한 호중구와 유사하게 염증성 질환의 활동에 중요한 역할을 하는 시토카인을 생성하며 NLR과 마찬가지로 PLR도 특정 질환에서 염증의 지표로 사용되고 있다. 특정 악성종양 및 만성질환에서 임상적 및 병리학적 특성과 PLR의 상관관계가 밝혀졌고[16-18], 말초동맥질환 및 허혈에서 PLR의 상승을 보였다[19]. Uslu 등[13]은 류마티스 관절염 환자에서 질환의 중증도와 PLR 사이에 상관관계가 있다고 하였으며, Wu 등[20]은 전신성 홍반성 루푸스의 중증도와 PLR 사이에 상관관계가 있다고 보고하였다.
Henoch–Schönlein 자반증의 중증도나 예후와 관련 있는 인자로 혈소판 증가, 백혈구 증가, CRP의 상승 등이 보고되었고[4,5], Makay 등[21], Gayret 등[23]에 의해 처음으로 Henoch–Schönlein 자반증에서 위장관 출혈과 NLR, PLR의 연관성이 보고되었다. Makay 등[21]에 의하면 위장관 출혈을 동반한 Henoch–Schönlein 자반증 환아에서 NLR이 유의하게 증가하였고 위장관 출혈을 예측하기 위한 NLR의 cut-off는 2.82로 81.0%의 민감도와 76%의 특이도를 보였다. Gayret 등[23]은 처음으로 PLR와 위장관 출혈과의 연관성을 입증하였고 위장관 출혈군에서 비출혈군에 비해 PLR이 유의하게 증가하였으나(P=0.001), NLR과의 통계적 유의성은 찾지 못하였다(P=0.060).
본 연구에서는 Henoch–Schönlein 신염 환아에서 Henoch–Schönlein 신염이 동반되지 않은 환아에 비해 RDW과 NLR이 유의하게 증가하였고(P=0.032, P=0.027), 로지스틱회귀분석에서도 NLR이 Henoch–Schönlein 신염의 독립적인 예측인자임을 확인하였다(P=0.042). 하지만 Henoch–Schönlein 신염과 PLR의 연관성은 찾지 못하였다. 본 연구에서 얻은 cut-off 치는 3.315로 민감도와 특이도는 각각 60.0%, 80.5%였는데 위장관 출혈의 예측인자로서 cut-off 치를 2.82로 제시하였던 앞선 연구와는 차이를 보였다[21].
이상의 결과로 저자들은 NLR이 신염이 동반된 Henoch–Schönlein 자반증 환자에서 초기에 증가되어 있는 것을 발견하였다. NLR은 특별한 장비 없이 전혈구 계산에서 간단히 구할 수 있어 이들이 Henoch–Schönlein 자반증 환자에서 신염의 조기 지표로 편리하게 사용될 수 있을 것으로 생각된다.
고려해야 할 몇 가지 한계점으로 첫째, 본 연구는 후향적 단면연구로 NLR의 변화양상에 대해서는 알 수 없었고 둘째, NLR과 Henoch–Schönlein 신염의 예후 사이의 관계에 대해서는 평가하지 않았다. 셋째, 염증에 더욱 민감한 IL-1, IL-6 및 TNF-α와 같은전염증성 시토카인과 NLR과의 관계에 대해서 평가하지 않았다.
결론적으로, Henoch–Schönlein 신염 환자에서 NLR이 신염이 동반되지 않은 환자 혹은 정상 대조군에 비해 유의하게 높다는 것을 입증하였고 또한 본 연구는 NLR이 Henoch–Schönlein 신염의 독립적인 예측인자가 될 수 있으며 3.315보다 높은 수치에서 Henoch–Schönlein 신염을 예측하는 데 유용하다는 것을 확인하였다. 그러나 정확한 cut-off 치의 확인 및 NLR의 정확한 역할을 연구하기 위해 더 많은 연구가 필요할 것으로 생각된다.