Nuss방법에 의한 Pectus Excavatum 교정 후 회복실에서 비캐뉼라를 통한 각각 다른 산소량의 효과
The Effect of Different Oxygen Flow Rates via Nasal Cannula in Recovery Room after Pectus Excavatum by the Nuss Procedure
Article information
Trans Abstract
Objective
In pectus excavatum patients, Nuss procedure provides excellent cosmetic results, but it cause hypoxemia and hypercarbia by the reduction of alveolar ventilation due to severe thorax expansion and pain after operation. This study was designed to evaluate the effect of different oxygen flow rates via a nasal cannula in recovery room after correction of pectus excavatum by Nuss procedure.
Methods
Forty patients (3–12 years old) undergoing pectus excavatum repair were randomly assigned and divided into two groups. Patients were given 200 mL/kg/min flow of 100% oxygen (group 1) and 100 mL/kg/min flow of oxygen (group 2) via nasal cannula in the recovery room. Arterial blood gas analysis and peripheral oxygen saturation were measured at arrival and after 5, 10, 15, and 30 minutes in the recovery room.
Results
In group 1 compared with group 2, decrease of PaCO2 (partial pressure of CO2 in arterial blood) accumulation was observed in 5, 10, and 15 minutes. Arterial oxygen pressure (PaO2) difference was not significant between the group. But, in comparison within groups, PaO2 level was significantly higher at 5, 10, 15, and 30 minutes than just after arrival at the recovery room. In both group, heart rate and systolic blood pressure were no significant difference.
Conclusion
We recommend that 200 mL/kg/min flow of 100% oxygen should be administered to patients who were taken Nuss procedure for prevention of hypoxemia and hypercarbia in recovery rooms.
서 론
오목가슴은 전흉벽이 선천적으로 함몰된 질환으로 전흉벽 기형 중 가장 흔하며 출생 후부터 점차 진행한다. Nuss 등[1]은 양측 옆구리에 2 cm 정도 피부절개 후, 정상 흉부모양으로 구부린 금속막대를 함몰된 흉골 부위와 심장 사이로 통과시킨 다음 180도 회전시켜 정상적인 가슴모양을 만들면서 상처부위를 최소화하는 방법을 고안하였다. 그러나 이 방법은 금속막대의 삽입으로 과도한 흉곽의 팽창에 따른 흉곽의 탄력성 감소와 폐기능 변화, 통증에 의하여 수술 후 호흡장애가 발생할 수 있다[2-4].
소아는 성인에 비하여 호흡장애가 더 빈번히 발생하는데, 이유는 흉곽과 폐의 탄성반동이 낮고 기능적 잔기량이 감소되어 있어서 기도폐쇄, 환기/관류 불균형, 폐 내 션트가 수술 중과 수술 후에도 지속될 수 있기 때문이다[5]. 따라서 Nuss 수술을 받는 소아환자는 수술 후 회복실에서의 적절한 통증조절과 산소요법이 필수적이다. 환자 감시에 사용되는 pulse oximeter는 저산소증 발견에 유효하나, 산소공급과 함께 사용 시에는 저호흡증이나 무호흡증 발견을 지연시킬 수 있기 때문에 적절한 환기상태를 평가하기 위해서 동맥혈 가스분석을 감시하는 것이 필요하다[6].
본 연구와 다른 수술에서의 비교이긴 하지만, Kim 등[7]은 Ravitch 수술받은 환자에게 T-piece를 통한 산소공급 시 저유량군에서 고유량군보다 이산화탄소 분압이 의미 있게 높다고 하였다. 이에 저자들은 Ravitch와는 다른 술식인 Nuss방법에 의한 오목가슴 수술 후 회복실에서 비 캐뉼라를 통한 산소유량 변화가 동맥혈 가스분석의 이산화탄소분압과 산소분압, 활력징후에 미치는 영향을 알아보고자 한다.
대상 및 방법
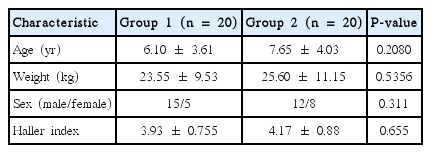
오목가슴으로 Nuss 수술을 받는 3–12세의 소아환자 중 미국 마취과학회 신체등급분류 1, 2에 해당하는 40명을 대상으로, 연구시행 전 순천향대학교 천안병원 연구윤리심의위원회 승인(SCHCA-IRB 2011-110) 후 환자보호자에게 본 연구의 목적과 방법에 대하여 설명 후 동의를 받았다. 마르팡증후군, 심장 및 호흡기질환이 있는 환자는 대상에서 제외하였다. 수술 전 Haller 등[8]이 흉부 컴퓨터 단층촬영을 이용하여 연구한 Haller index (internal transverse distance of the thorax/vertebral–sternal distance at the most depressed portion)를 측정하였으며, 각 군의 나이, 체중, 성별, Haller index의 차이는 없었다(Table 1).
수술 전 투약으로 glycopyrrolate 0.04 mg/kg을 수술 30분 전에 근주하였다. 감시장치(M1029; Hewlett Packard Co., Palo Alto, CA, USA)를 이용하여 혈압, 맥박, 맥박산소포화도를 측정하였으며 모두 정상범위였다. 마취 유도는 2.5% thiopental sodium 5 mg/kg과 rocuronium 0.6 mg/kg을 정주한 후 기관 내 삽관하였고 sevoflurane 2.0–3.0 vol%, air 2 L/min, 산소 2 L/min로 마취 유지를 하였다. 수술 시작 시와 종료 5분 전에 통증조절을 위하여 fentanyl 1.0 μg/kg을 정주하였고, 마취 유도 후 요골동맥에 24 gauge angio catheter를 거치하고 동맥혈 가스분석(Rapid 348; Chiron Co., Emeryville, CA, USA)을 시행하여 정상범위임을 확인하였다. 수술 종료 10분 전 수술 합병증검사를 위해 portable chest anterior-posterior 촬영을 하였으며 pneumothorax, hemothorax 등의 합병증이 없는 경우 마취 각성을 시작하였다. 근이완 역전을 위해 glycopyrrolate 0.008 mg/kg과 pyridostigmine 0.2 mg/kg을 정주하고 100% 산소를 흡입시키며 각성을 유도하였고 자발호흡이 충분히 돌아왔을 때 발관한 후 마스크로 100% 산소를 공급하였다. 마취 후 회복 상태를 판단하는 Aldrete scoring system이 9–10점에 도달하였을 때 산소공급 없이 회복실로 환자를 옮겼으며 옮길 때 걸린 시간은 1분 이내로 하였다[9].
회복실 도착 후 shivering을 방지하고 정상체온을 유지하기 위하여 열성 담요를 이용해 체온을 유지하였고, 산소가습장치(Respiflo MN; Kendall Co., Mansfield, MA, USA)가 부착된 비 캐뉼라(nasal cannula salter style; Salter Labs, Carlsbad, CA, USA)를 사용하여 각 군 20명씩, 1군 100% 산소 200 mL/kg/min, 2군 100% 산소 100 mL/kg/min를 흡입시키면서 회복실 도착 직후, 5, 10, 15 및 30분에 동맥혈 이산화탄소분압, 산소분압, 맥박, 수축기혈압을 측정하여 기록하였다.
수술 후 통증조절을 위하여 회복실에서 fentanyl 0.5 μg/kg/hr을 5% 포도당 용액에 혼합하여 총 60 mL의 용액으로 만들어 시간당 1 mL의 속도로 주입하도록 하였으며 통증이 심하면 버튼을 눌러 추가적으로 0.5 mL가 주입될 수 있도록 환자와 보호자를 교육하였다.
이전 연구자료에 기초하여 알파값 5%와 80% 파워로 표본수를 산정하였고 통계는 SAS ver. 9.1 (SAS Institute Inc., Cary, NC, USA)을 사용하였다. 각 자료의 결과는 mean±standard deviation로 나타냈으며 두 군 간 체중, 나이, Haller index의 비교에 unpaired T-test를 사용하였고 성별은 chi-square test로 비교하였으며, 각 시기의 군 간 비교를 위해서 repeated measured analysis of variance test를 시행하였고 P값이 0.05 미만인 것을 유의한 차이가 있는 것으로 하였다.
결 과
회복실 도착 당시 동맥혈 이산화탄소분압의 유의한 차이는 없었지만 도착 후 5분, 10분, 15분에서는 group 1에서 group 2보다 낮게 측정되었으며(P<0.05), 30분 경과 시에는 차이가 없어졌다(Fig. 1). 동맥혈 산소분압은 group 1과 group 2의 모든 시점에서 군 간 유의한 차이는 없었지만, 군 내 비교 시 두 군 모두에서 회복실에 도착했을 때보다 산소를 공급한 5분 이후가 유의하게 증가하였다(P<0.05) (Fig. 2). 맥박수에서는 군 간 유의한 차이는 없었다(Fig. 3). 수축기혈압은 군 간 유의한 차이가 없었다(Fig. 4).

The change of PaCO2 (partial pressure of CO2 in arterial blood) with time after postanesthetic care unit administration. Values are presented as mean± standard deviation. Group 1, 100% oxygen supply 200 mL/kg/min via nasal cannula; group 2, 100% oxygen supply 100 mL/kg/min via nasal cannula; PACU, postanesthesia care unit. a)P< 0.05 compared with group 1.

The change of PaO2 (arterial oxygen pressure) with time after postanesthetic care unit administration. Values are presented as mean± standard deviation. Group 1, 100% oxygen supply 200 mL/kg/min via nasal cannula; group 2, 100% oxygen supply 100 mL/kg/min via nasal cannula; PACU, postanesthesia care unit.
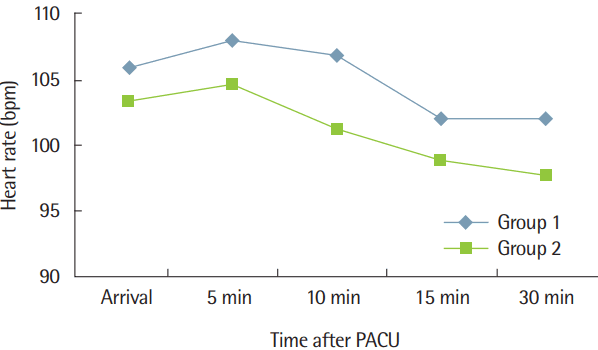
The change of heart rate with time after postanesthetic care unit administration. Values are presented as mean± standard deviation. Group 1, 100% oxygen supply 200 mL/kg/min via nasal cannula; group 2, 100% oxygen supply 100 mL/kg/min via nasal cannula; PACU, postanesthesia care unit; bpm, beat per minute.
고 찰
오목가슴은 소아 전흉벽 기형 중 가장 흔한 질환으로 출생 후부터 점차 진행하여 검상돌기 부위에서 가장 심한 함몰을 보이며 발생빈도는 0.14%–0.8%로 보고되어있다[10]. Haller index는 오목가슴 환자에서 기형의 정도를 판단하는 방법으로 3.25 이상이면 기형 정도가 심하여 수술이 적응된다고 하였다[8]. 본 연구의 경우 Haller index가 3.93±0.755, 4.17±0.88로 비슷하여 술 후 통증의 정도는 비슷하였을 것이라 생각된다.
회복실에서 저산소증 발생을 감소시키기 위하여 산소요법을 시행하게 되는데, Ayhan 등[11]은 갑상선절제술을 받은 성인환자에게 산소를 공급할 때, 비 캐뉼라가 마스크보다 맥박 산소포화도를 증가시키고 만족도도 높다고 하였으며, Spence 등[12]은 유·소아에게 비 캐뉼라를 통한 2–10 L/min의 고유량의 산소공급이 효과적으로 맥박 산소포화도를 높여주며 호흡수를 감소시켜 호흡일을 줄여주고 안락감을 느끼게 해준다고 하였다.
최근 미숙아에서 성인에까지 호흡보조를 위하여 2–40 L/min의 고유량의 가온, 가습된 산소공급이 비 캐뉼라를 통하여 시행되고 있다. 고유량 산소치료의 기전은 다음과 같이 생각해볼 수 있다. Dewan과 Bell [13]은 고유량 산소치료는 비인두 사강의 이산화탄소를 제거하여 폐포의 이산화탄소, 산소분압을 호전시킨다고 하였다. Shepard와 Burger [14]는 비인두의 팽창성은 흡기 시 저항을 증가시키는데, 적절한 유량공급은 흡기저항을 감소시켜 호흡일을 줄인다고 하였고, Greenspan 등[15]은 가온, 가습된 가스는 차갑고 마른 가스보다 전도와 폐유순도를 증가시킨다고 하였다. 비강이 호흡가스를 가온시키는 역할을 감소시킴으로 대사로 소모되는 일을 줄여준다는 보고가 있으며, 비인두에서의 고유량 산소가 폐 확장을 위한 양압을 제공해준다는 보고도 있었다[12]. 본 연구의 group 1에서 동맥혈 이산화탄소분압이 감소되어 나타난 것은 이러한 효과로 비인두 사강의 이산화탄소를 감소시켜 재호흡 방지에 기여한 결과로 보여진다.
Kim 등[7]은 비흉곽 수술을 받은 소아환자에서 T-piece를 사용하여 100 mL/kg/min의 산소를 공급한 대조군과, Ravitch방법으로 오목가슴 수술을 받은 소아환자에게 100 mL/kg/min(저유량) 또는 200 mL/kg/min(고유량)의 산소를 주었을 때의 비교군과의 연구에서 동맥혈 이산화탄소분압과 산소분압을 측정하였는데, 저유량군에서 대조군보다 동맥혈 산소분압은 감소하고 이산화탄소분압은 증가한다고 하였고, 고유량군에서는 대조군과 차이가 없으며, 저유량군에서 고유량군보다 이산화탄소 분압이 의미 있게 높다고 하였다. 따라서 저자들은 흉곽 수술을 받는 소아환자에게 보다 많은 산소유량을 공급할 것을 권하고 있다. 본 연구에서는 군 간 동맥혈 산소분압의 차이는 보이지 않았는데, 이는 Ravitch와 Nuss 수술 방법의 차이, 산소공급장치의 차이, Nuss방법에 사용된 금속막대 자체의 흉곽운동성 제한이 두 연구결과의 차이를 야기할 수 있을 것이다. Marshall과 Wyche [16]는 수술 직후 조기 저산소증을 일으키는 원인으로 기능적 잔류용량의 감소, 폐 내 션트와 사강의 증가, 과용량의 아편 유사제나 마취제에 의한 호흡억제와 근이완제 잔류 효과 등을 보고하였다. 본 연구에서는 fentanyl을 수술 전, 종료 5분 전 1 μg/kg로 통증이 극심한 시기에 최대효과가 나타나도록 균등히 사용하였고, Aldrete score 9–10점의 마취 회복이 된 후에 회복실로 이동하였다.
Foster 등[17]이 발표한 회복실에서의 수축기혈압 차이와 통증과의 관계를 비교할 때 수술 후 통증의 군 간 차이는 없었지만, fentanyl의 감수성이 환자마다 다르고 통증의 정도를 객관화하지 않은 점은 본 연구의 제한점 중 하나이다. Soliman 등[18]과 Tyler 등[19]은 회복지수가 수술 후 저산소증 발생과 관련이 없다는 보고를 하였고, Motoyama와 Glazener [5]는 각성상태에서 저산소증 회복이 빠르다고 보고하였다. 논란이 지속되고 있는 점으로 본 연구에서 동맥혈 채취 당시의 회복지수를 측정하지 않은 점도 제한점이 될 수 있겠다. 비 캐뉼라를 통하여 산소공급 시에 비호흡 또는 구강호흡을 하였는가 하는 점도 제한점이 될 수 있다. Wettstein 등[20]은 성인에서 비 캐뉼라로 산소공급을 받을 때 구강호흡을 하는 것이 흡기 산소압을 높여준다고 하였지만, Kubicka 등[21]은 작은 소아에서 비호흡을 할 때만 지속적인 양압효과를 줄 수 있다고 하였다.
본 연구에서 Nuss방법으로 전흉부교정술을 받은 소아환자에게 비 캐뉼라를 통하여 각 각 100% 산소 200 mL/kg/min과 100 mL/kg/min의 산소공급을 해주었을 때 군 간 산소분압의 차이는 없었지만, group 1에서 group 2보다 회복실 도착 후 5, 10, 15분의 동맥혈 이산화탄소분압의 감소가 관찰되었다. 산소유량 변화에 따른 군 간 산소분압의 차이는 없었지만 보다 많은 산소유량을 공급하는 것이 해부학적 사강의 이산화탄소를 제거해서 재호흡을 감소시켜 동맥혈 이산화탄소 축적을 감소시키는 효과가 있으므로, Nuss 수술을 받은 소아환자에게 회복실 도착 30분까지는 충분한 유량의 산소를 공급해야 할 것으로 생각된다. Nuss 수술을 받은 환자의 적절한 산소공급 유량을 알기 위해서 대조군과의 비교와 더 다양한 유량의 산소를 공급한 연구가 필요하다고 생각된다.
Nuss 수술을 받는 40명의 소아환자를 대상으로 회복실에서 비 캐뉼라를 통한 산소공급 유량 변화에 따른 영향을 알아보고자 회복실 도착 시, 5분, 10분, 15분, 30분에 동맥혈 이산화탄소분압과 산소분압, 맥박과 수축기혈압을 측정하여 다음과 같은 결과를 얻었다. (1) Group 1이 회복실 도착 직후, 5, 10, 15분에 group 2보다 동맥혈 이산화탄소분압의 증가가 적었다. (2) Group 1과 group 2의 비교에서 회복실 도착 직후, 5, 10, 15, 30분의 동맥혈 산소분압 차이는 없었다. (3) 두 군 모두에서 맥박과 수축기혈압은 유의한 차이가 없었다.
이상의 결과를 종합하여 볼 때 오목가슴으로 Nuss 수술을 받은 소아환자는 수술 후 흉곽팽창과 통증으로 인한 호흡장애로 회복실에서 동맥혈 이산화탄소분압 및 산소분압의 불균형이 초래될 수 있으므로 적절한 통증조절과 함께 비 캐뉼라를 통한 산소유량을 200 mL/kg/min 이상으로 공급해야 동맥혈 이산화탄소분압 증가를 감소시킬 수 있어서 적절한 산소요법의 효과를 얻을 수 있을 것으로 생각된다.