난소갑상선종 1예
Struma Ovarii: A Case of Struma Ovarii and Literature Review
Article information
Trans Abstract
Struma ovarii is a rare, monodermal and highly specialized teratoma, composed entirely or predominantly (>50%) of thyroid tissue. Presenting symptoms are not specific. Despite containing thyroid tissue, only 5% of struma ovarii have features of hyperthyroidism. Therefore, preoperative diagnosis of struma ovarii is difficult. Recently, the authors experienced a case of struma ovarii found in a young woman who presented with known pelvic mass and dysmenorrhea. A transabdominal ultrasonography and computed tomography detected a 16-cm sized multiloculated mass in pelvic cavity. She underwent laparoscopic unilateral ovarian wedge resection. The final histopathologic diagnosis was struma ovarii of the mature cystic teratoma. Therefore, we report this rare case with a brief review of the literature.
서 론
난소갑상선종은 드물게 나타나는 난소종양으로, 갑상선조직이 양성 낭포성 기형종의 50% 이상을 차지하는 기형종의 단배엽 특이 종양이다[1]. 난소갑상선종은 모든 난소종양의 1%, 난소기형종의 2.7%에서 나타난다[2,3]. 이 종양은 1889년 Boettlin [4]에 의해 난소에 갑상선 난포조직이 있음이 발견되었으며 Gottschalk [5]에 의해 처음으로 보고되었다. 환자의 대다수가 무증상이고, 임상적으로 갑상선 기능을 지닌 경우는 5% 미만으로 알려져 있다[6]. 대개 갑상선 기능 항진증과 같은 동반증상이 드물기 때문에 골반종괴로 수술 후 진단되는 경우가 대부분이다[7]. 대개는 양성 경과를 나타내므로 외과적 적출술로 치료되지만 약 5%에서는 악성변화가 발생한다[6]. 난소갑상선종은 난소 종괴의 50% 이상에서 갑상선조직이 우세하게 발견되면 진단이 가능하다. 저자들은 오른쪽 난소에서 발생한 난소갑상선종 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
평소 심한 월경 곤란증이 있던 24세 미혼 여성이 개인 산부인과 의원을 방문하여 복부초음파를 시행한 결과 거대 난소종양이 관찰되어 순천향대학교 의과대학 천안병원 산부인과 외래로 의뢰되었다. 산과력은 0-0-0-0인 성교경험이 없는 환자로 초경은 16세, 최종 월경일은 2014년 6월 15일이었으며, 월경주기는 규칙적이고 기간은 4-5일간이며 양은 중등도를 보이는 월경력을 보였고, 평소 심한 월경 곤란증이 있었다. 과거력 및 가족력상 특이사항은 없었다.
환자의 전신상태는 양호하였고 외견상 특이한 소견은 없었다. 신장은 161 cm, 체중은 65 kg, 혈압은 110/70 mm Hg, 맥박은 60회/분, 호흡수 18회/분, 체온은 36.5°C였다. 복부는 약간 팽대되어 있었다. 성교경험이 없어서 골반진찰은 시행하지 않았다.
영상학적 검사상 내원 시 시행한 복부 초음파상 자궁은 정상이었으며 오른쪽 난소에 16×10 cm 크기의 종양이 관찰되었다(Fig. 1A). 종양은 불규칙한 모양을 가지며 내부에 음영이 있고 중격을 형성하고 있었다. 좀 더 정확한 종양의 양상을 알아보기 위해 복부 및 골반 컴퓨터단층촬영을 시행하였으며 오른쪽 난소에 12 cm 크기의 다중격 낭성종양이 관찰되었다(Fig. 1B). 복수, 흉수 등 그 외에 특이소견은 없었다. 혈액검사, 흉부 X선 촬영 등에서는 이상이 없었으며 혈중 cancer antigen 125 (CA 125) 수치는 17.98 IU/mL (범위, 0-35 IU/mL), carbohydrate antigen 19-9 (CA 19-9) 수치는 18.89 U/mL (범위, 0-34 U/mL)로 정상범위였다.
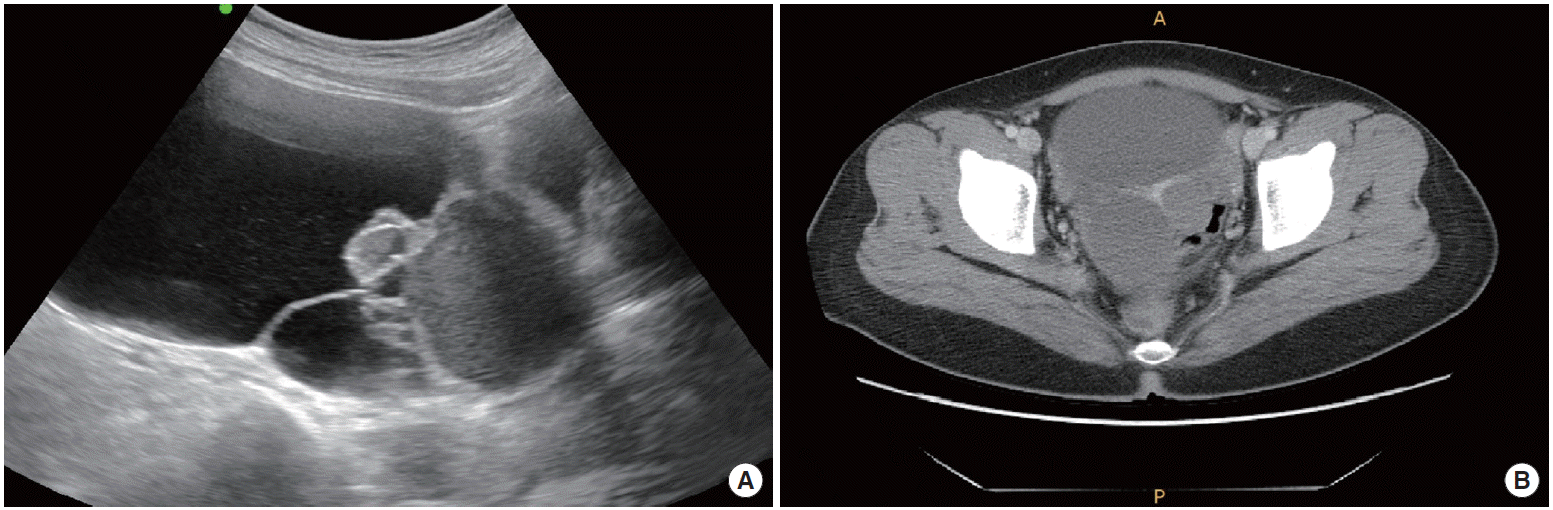
(A) The images of pelvic ultrasonography and (B) computed tomography. (A) A 16✕ 10 cm sized multi-cystic tumor of right ovary. (B) About 12-cm sized multiseptated cystic mass with internal septation and enhancing thick septa in the right ovary.
환자는 전신마취하에 복강경 수술을 시행하였다. 복강 내 소견은 자궁은 정상 크기였으며, 표면은 매끈하였다. 왼쪽 난소는 정상 크기와 형태를 보였고 오른쪽 난소에 약 16 cm 크기의 낭성종양이 있음을 확인했다. 주위와의 유착은 없었다. 복강 내에 복수는 없었고 간, 장관, 횡경막, 장간막, 주위의 임파절 및 복막에서 촉진되는 종괴는 없었다. 오른쪽 난소부분절제술을 시행하였으며 수술 중 종양의 파열이 있었다.
수술 후 시행한 병리학적 소견으로 종양은 고형성 절편이 일부 관찰되었으며 대부분은 얇은 낭성조직이었다. 현미경적 소견상 고형성 부분은 다양한 크기의 여포성 병변이었으며 여포의 내부는 콜로이드와 대식세포들로 차 있었다(Fig. 2A). 고배율상 여포를 구성하고 있는 주위의 세포는 편평하거나 둥근 양성세포로 이형성은 없었다(Fig. 2B). 면역화학조직염색상 여포를 구성하는 세포는 갑상선 유래 여포세포의 표지자인 thyroid transcription factor 1에 양성이었다(Fig. 2C). 낭성조직에서는 내벽을 피복하고 있는 상피세포는 없었으며 변성된 섬유성 조직으로만 구성되었다(Fig. 2D). 다른 연골, 피부, 신경 등 일반적인 기형종에서 보이는 조직은 관찰되지 않았다. 수술 후 경과 중 특별한 합병증은 없었으며, 수술후 4일째 퇴원하였다. 수술 후 실시한 갑상선기능검사에서 T3 1.10 ng/mL (범위, 0.8-2.0 ng/mL), free T4 1.27 ng/dL (범위, 0.93-1.7 ng/dL), 갑상선호르몬 (thyroid stimulating hormone) 2.77 μIU/mL (범위, 0.27-5.0 IU/mL)은 모두 정상범위였고, thyroglobulin 검사는 시행하지 않았다.
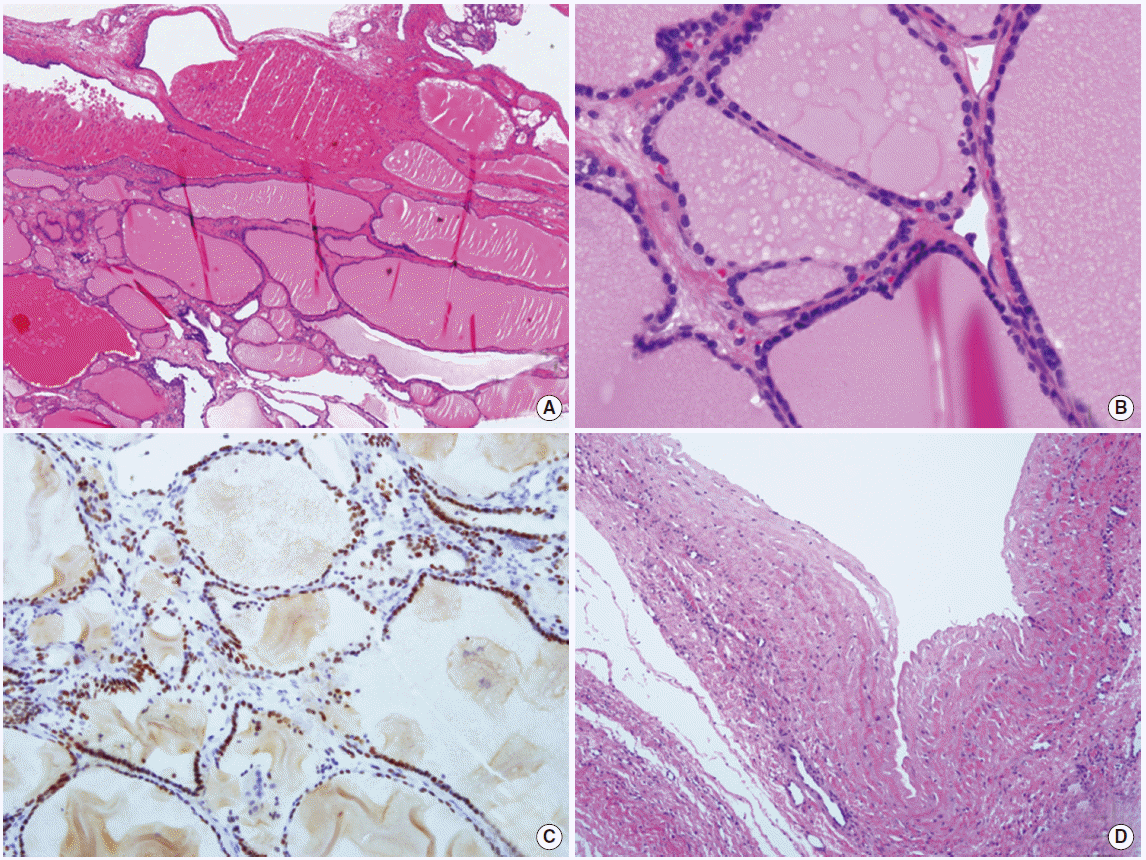
Histopathology findings. (A) Solid areas consisted of variable sized follicular structures containing colloid materials and colloid-laden macrophages (H&E, ✕ 100). (B) On high power examination, the follicles were composed of bland-looking flat to cuboidal cells with no histologic atypia (H&E, ✕ 400). (C) Immunohistochemical stain for thyroid transcription factor 1 was strong positive in the follicular epithelial cells (PAP method, ✕ 200). (D) Most cystic area showed only degenerated fibrotic tissue (H&E, ✕ 40).
고 찰
난소갑상선종은 난소의 기형종에서 분화된 갑상선조직으로 형성된 난소종양이며, 갑상선조직이 전체 조직의 50% 이상으로 구성되어야 진단할 수 있다[8]. 난소에 존재하는 갑상선조직은 생화학적, 조직학적 소견 등이 경부의 갑상선조직과 동일하다. 난소의 기형종은 병리학적으로 성숙형, 미성숙형, 그리고 단배엽성(monodermal) 혹은 고도로 특수화된 기형종의 세 가지 형태로 분류되는데, 난소갑상선종은 단배엽성 기형종에 속한다[9]. 난소갑상선종은 전체 기형종 중 약 2.7%를 차지하고 모든 난소종양의 0.3% 정도에서 발생한다[3].
이 종양은 모든 연령층에서 발생될 수 있으나 난소갑상선종 환자의 약 85%는 폐경기 이전 연령층에 속한다고 알려져 있으며[10], Kim 등[11]의 연구에 따르면 연령분포는 20-70세였으며 평균연령을 40.5세로 보고하였다. 본 증례의 경우 연령이 24세로 이전의 연구보고와 큰 차이를 보이지는 않았지만 비교적 낮은 연령에 속하고 있었다.
난소갑상선종은 대부분이 일측성으로 증상이 없이 큰 종괴로 나타나며[12], 성숙 기형종과 흔히 동반되거나 드물게는 반대측에 낭선종이 발생하기도 한다. 그러나 5-8% 정도에서는 상당한 양의 갑상선호르몬을 분비하고 이런 경우에는 갑상선 기능 항진증의 임상소견을 나타낼 수 있다[13]. Szyfelbein 등[13]이 난소갑상선에서 생성된 호르몬 영향으로 인해 기능성 자궁출혈, 월경통, 불임, 안면 홍조등의가능성을보고하였다. 크기는다양하나보통직경 10 cm를 넘지 않는다. 조직의 육안적 소견상 성숙 기형종과 비슷하며 때로는 유착과 동반되기도 한다[14]. 본 증례에서는 오른쪽에 발생한 종괴를 관찰할 수 있었고 반대쪽 난소는 정상으로 관찰되었다. 그러나 종양의 크기는 16 cm 정도로 관찰되어 이전 보고에 비해 크기가 큰 종괴였다. 수술 전 갑상선기능검사를 시행하지 않았으나 갑상선 기능 항진증의 임상소견은 관찰되지 않았다. 그 외 심한 월경통을 호소하였으나 난소갑상선종에서 생성된 호르몬의 영향인지 수술 후 추적관찰을 통해 월경통의 호전에 대한 확인이 필요할 것으로 생각된다.
수술 전에 임상적으로 혹은 영상의학적 검사로 정확한 진단은 매우 힘들며, 악성종양이나 난소기형종 의심하에 외과적 적출술 시행 후 조직학적 소견으로 진단되는 경우가 대부분이다. 영상의학적 진단은 컴퓨터단층촬영, 자기공명영상, 질식초음파 등을 시행할 수 있으나 특이도는 높지 않다. 또한 수술 전 I-131을 이용한 신티그래피를 시행할 수 있으며 이는 골반 내 활성화되어 있는 갑상선조직을 찾아낼 수 있다. 하지만 전갑상선절제술을 시행하지 않았다면 I-131 스캔은 추적관찰에 유용성이 없다[15].
CA 125는 난소상피암의 80%에서 증가소견을 보이는데, 자궁내막, 장, 유방, 폐 또는 다른 종양에서도 일부 증가되며, 그 외 생리주기, 임신, 자궁내막증, 골반내염증 등에서도 증가될 수 있다[16]. 또한 CA 125 수치의 증가로 악성 여부 또한 판단할 수 없고 난소갑상선종에서 CA 125 증가소견을 보이는 경우는 드물지만, 이 경우 모두에서 복수를 가진다고 하였고 이는 종양 자체보다는 복수에 의한 이차적인 효과의 가능성이 있다고 하였다[16]. 때문에 수술 전 진단에 있어 CA 125의 유용성은 한계가 존재할 수 밖에 없다. 본 증례의 경우 CA 125 수치의 증가는 없었으며 수술 시 복수는 관찰되지 않았다.
대부분의 난소갑상선종은 양성이며 난소 혹은 난소-난관절제술로 치료할 수 있다. 그러나 5-10%에서는 악성종양의 발생이나 복수, 복수와 흉수의 동반 등의 합병증이 생긴다고 보고되었다[14]. 난소의 갑상선종이 양성일 경우 치료와 예후는 양성 난소 기형종과 비슷하며, 수술 시 소견이나 연령에 따라 치료방법이 결정되어야 한다. 악성인 경우에는 전자궁적출술과 양측 부속기 절제술의 근치적 수술과 화학요법의 병행부터 수술 시에 질병 진행의 증거가 없을 시 연령이나 향후 임신 가능성에 관한 고려로 생식기능을 보존하기 위한 고식적 수술에 그치는 정도까지로 수술의 범위가 넓다. 재발성 혹은 전이성 난소갑상선 종은 방사성 요오드로 성공적으로 치료되어 오고 있다[6]. 본 환자의 경우는 24세의 미혼 여성으로 연령과 종괴피막 파열이 없고 복강 내 복수 및 전이가 없었던 소견을 고려하여 난소 일부 절제술만 시행하였다. 요오드 주사(scan)와 thyroglobulin의 측정은 치료 후 추적관찰 및 재발유무 확인을 위해 필요하다. 특히 thyroglobulin은 양성과 악성 난소갑상선종 모두에서 생성되며 혈청 내 증가는 재발과 전이 예측에 유용한 표지자가 된다고 보고하고 있다[17,18]. 난소갑상선종은 대부분이 무증상이고, 갑상선 기능 항진증과 같은 동반증상이 드물기 때문에 거대 골반종괴로 수술을 시행하게 되고 이후 조직학적으로 진단되는 경우가 대부분이다. 본 환자에서도 특이증상 없이 거대 골반종괴 의심하에 수술을 시행하였고, 따라서 수술 시행 전 갑상선기능검사나 thyroglobulin을측정하지않았다. 병리적 진단 후에 갑상선기능 검사를 시행하였으나 모두 정상소견을 보였다. 이후 재발유무 확인을 위해 thyroglobulin 검사를 추가로 시행할 필요가 있을 것으로 생각된다.
난소갑상선종 중 약 5%에서 악성변화를 한다고 보고되어 있고 악성으로의 형질 변환 중 가장 흔한 타입은 유두상 암종(papillary carcinoma)이며, 그다음은전형적인난포상암종(typical follicular carcinoma)이 따르고 있으며, 드물긴 하지만 난소에서 기원하는 분화도가 높은 여포상 암종(highly differentiated follicular carcinoma of ovarian origin)도 발생한다[19]. 대부분은 편측으로 발생하며 일반적으로 폐경기 이후의 여성에서 나타나는 것으로 알려져 있으나, 어느 연령에서나 발생 가능하다[20]. 악성 난소갑상선종은 약 5%에서 전이가 보일 정도로 드물며 또한 진행이 느리다. 전이는 복막을 통해 장간막이나 대망으로 발생하나 혈류를 통해 간, 뇌, 골조직, 폐 또는 반대측 난소로도 일어난다. 하지만 대개는 복강 내에 국한되는 것이 일반적이다[17].
병리소견은 육안적으로는 대부분 평활한 표면을 가지며, 가끔 자궁벽에 유착이나 결절성 혹은 낭종을 나타내기도 하고 활면은 갑상선조직의 특유한 회백색 색조를 볼 수 있고, 때로는 상당수 혈관의 돌출, 괴사, 출혈 부위를 볼 수도 있다. 조직학적으로는 정상 갑상선조직과 비슷하며 원형의 낭포가 입방 혹은 원주상피로 둘러싸여 있으며, 이 낭포 속에는 eosin에 균등하게 침착되는 교질성 물질이 흔히 기포를 형성한다[21]. Devaney 등[21]은 난소갑상선종을 간유리모양핵(ground glass nuclei)의 존재와 증가된 세포분열성, 혈관침입 여부에 근거해 악성으로 분류하였는데 본 증례는 상기 소견을 보이지 않아 양성으로 진단되었다.
저자들은 우측 난소에서 발생한 난소갑상선종 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.