심바스타틴 간 손상 기왕력 환자에서 메티마졸 복용 후 발생한 급성 담즙정체성 간염 1예
Methimazole-Induced Acute Cholestatic Hepatitis in a Patient with History of Simvastatin-Induced Liver Injury
Article information
Trans Abstract
Methimazole and prophylthiouracil are commonly prescribed for patients with hyperthyroidism. The serious side effect of toxic hepatitis caused by these two drugs is well known. According to recent Korean and American management guidelines for hyperthyroidism, mehimazole is recommended as the first-choice antithyroid drug for the treatment of hyperthyroidism. Toxic hepatitis rarely occurs in methimazole users. We report a rare case of a 52-year-old female with toxic hepatitis after methimazole use that had past medical history of simvastatin induced liver injury.
서 론
갑상선기능항진증의 치료제로는 티오미다졸(메티마졸, 카비마졸)과 프로필타이오우라실(propylthiouracil, PTU) 등이 흔히 사용된다[1]. 항 갑상선제의 부작용은 두드러기나 발진, 관절염, 소화 불량과 같은 경미한 것에서[2] 드물게는 생명을 위협하는 무 과립구증이나 독성간염과 같은 중증 부작용까지 다양하게 발생할 수 있다[1]. 특히 PTU는 전격성 간염을 일으켜 간 이식수술이 필요한 경우도 보고되어[3,4], 대한갑상선학회와[3] 미국 갑상선학회 및 미국 임상내분비의사회에서[4] 제시한 가이드라인에서는 임신 첫 3개월 이내 혹은 갑상선중독증의 경우를 제외하고는 메티마졸 또는 카비마졸을 갑상선기능항진증의 치료제로 사용하도록 권고하고 있다. 두 약제가 간 기능이상을 초래하는 것은 개체특이 독성효과(idiosyncratic toxic effects) 때문인 것으로 알려져 있으며, PTU는 간 실질세포의 손상을 초래하는 간염형태로, 메티마졸은 담즙 정체성 황달형태로 나타나는 경향이 있다[5]. 메티마졸에 의한 간 손상은 매우 드물어서 국내외 문헌을 고찰해 본 결과 지금까지 총 30여개의증례(국내에서 11예, 해외에서 20여 개의 증례)가[2] 보고되었으며, 특히 다른 약제로 인해 약인성 간 손상의 기왕력이 있었던 환자에서 메티마졸에 의한 독성간염이 발생한 예는 보고된 바가 없다. 저자들은 심바스타틴(simvastatin) 유발성 간염을 진단받은 기왕력이 있는 52세 여성에서 그레이브스병을 진단받고 메티마졸을 복용 후 발생한 급성 담즙정체성 간염 1예를 경험하였기에 문헌 고찰과 함께 보고하고자 한다.
증 례
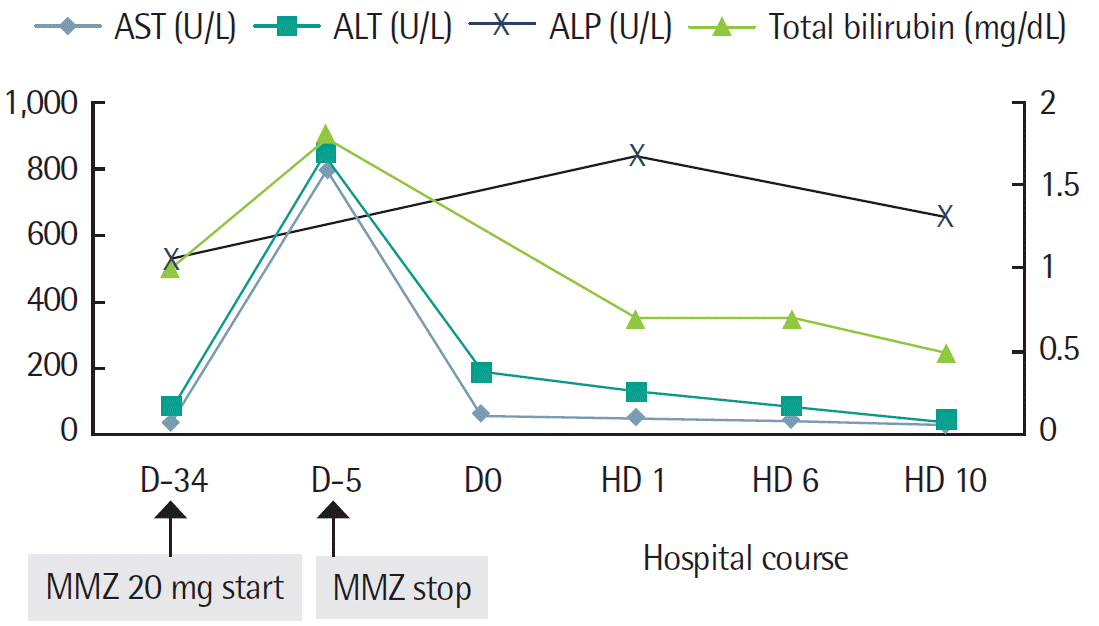
52세 여자 환자로 내원 3개월 전부터 2 kg의 몸무게 감소, 피로감, 더위를 못 참는 증상을 주소로 내원하였다. 내원하여 시행한 갑상샘자극호르몬(thyroid stimulating hormone, TSH) 0.18 μU/mL (정상범위, 0.25-4.0 mL), 유리 티록신(free thyroxine, free T4) 5.56 ng/dL (범위, 0.7-2.0 ng/dL), 트리요도타이로닌(triiodotyronine, T3) 376.63 ng/dL (범위, 60-190 ng/dL), 항 갑상선자극항체(thyroid-stimulating immunoglobulins, TSI) 38.50% (범위, 0-15%), 갑상선글로불린항체 0.28 U/mL (범위, 0-0.3 U/mL), 항 갑상선과산화효소항체가 0.94 U/mL (범위, 0-0.3 U/mL)로 양성이었고 적혈구침강속도는 31 mm/hr (범위, 0-30 mm/hr)였다. 신체 진찰에서 갑상선종이 확인되었고, 갑상선스캔에서는 섭취율이 5.0%로 상승되어 있었으며, 심전도는 동성빈맥(102회/min)이었다. 환자는 그레이브스병으로 진단받고, 메티마졸 10 mg을 하루 두 번씩 복용하기 시작하였다. 당시 시행한 혈액검사에서 아스파르테이트아미노 전이효소(aspartate aminotransferase, AST) 30 U/L (범위, 0-31 U/L), 알라닌아미노 전이효소(alanine aminotransferase, ALT) 46 U/L (범위, 0-31 U/L), 감마 글루타밀 전이효소(gamma-glutamyl transferase, GGT) 131 U/L (범위, 7-32 U/L)로 간 기능검사에서 경도의 간 기능이상 소견 외 특이소견은 관찰되지 않았다. 메티마졸을 10 mg씩 하루 두 번 20일간 복용하였다. 이후 외래 추적 혈액검사에서 AST 800 U/L, ALT 844 U/L, 총 빌리루빈 1.8 mg/dL (범위, 0.2-1.2 mg/dL)로 간 수치 상승소견이 있고 최근 피로감 증가를 호소하고 있어 메티마졸을 중단하고 원인 확인을 위해 입원하였다. 최근 한약이나 다른 약물의 복용력은 없었고 주 1회 소주 반 병의 음주력이 있었다.
6년 전 약제유발 간염의 기왕력이 있었다. 당시 순천향대학교 서울병원에 내원하기 2개월 전 개인의원에서 진단받은 고혈압과 고지혈증으로 하이드로클로로싸이아자이드 12.5 mg, 암로디핀 5 mg, 심바스타틴 20 mg 복용 중 정규 추적검사를 위해 시행한 간 기능검사 이상소견으로 순천향대학교 서울병원 내분비대사내과로 전원해왔고, 입원 후 AST 732 U/L, ALT 1,120 U/L, 총 빌리루빈 2.1 mg/dL, GGT 1,452 U/L, 알칼리 포스파타아제(alkaline phosphatase, ALP) 164 U/L (범위, 104-338 U/L)로 확인되었다. 심바스타틴 복용중단 및 하이드로클로로싸이아자이드 12.5 mg, 암로디핀 5 mg을 유지한 상태로 입원 14일째 초음파 유도하 간 생검을 시행하였으며 그 결과 급성 담즙정체성 간염으로 진단되었다(Fig. 1A-C). 이로 인해 당시 심바스타틴에 의한 독성간염으로 진단받았고 이후 정상 간 기능을 회복하고 고혈압에 대해 현재까지 암로디핀 5 mg을 복용 중이었다.
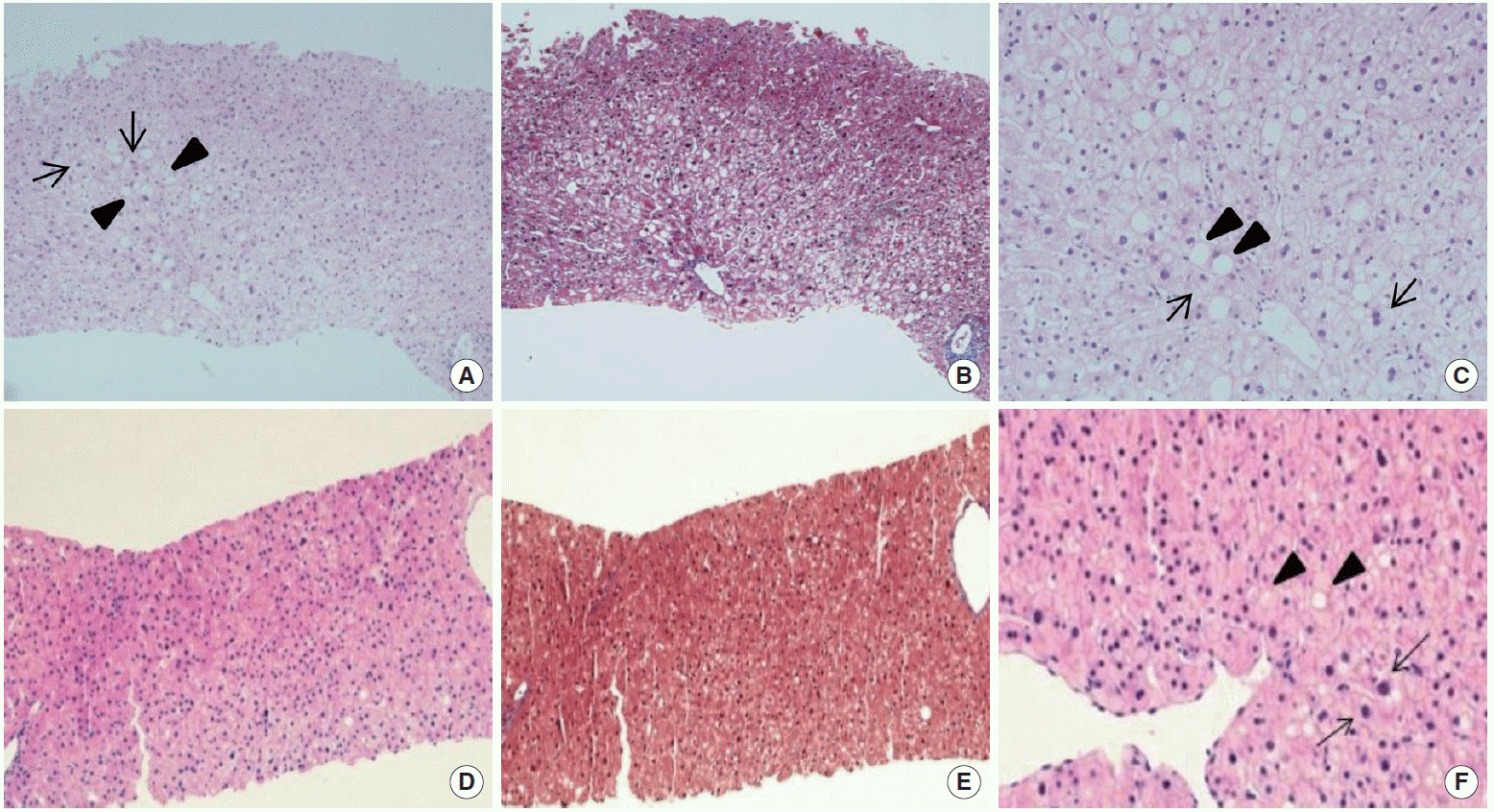
(A) Sections of the liver show centrizonal hydropic degeneration, regenerating hepatocytes (black arrows), and cholestasis (black arrowheads) (H&E, × 100). (B) The lobular architecture is preserved well (Masson’s trichrome, × 100). (C) Markedly swollen hepatocytes (black arrows) with cholestasis are noted in acinar zone 3 (black arrowheads) (H&E, × 200). (D, E) Low power view shows intact lobular architecture without any evidence of chronic liver disease (D: H&E, × 100; E: Masson’s trichrome, × 100). (F) There is mild cholestasis (black arrowheads) and regenerating hepatocytes (black arrows) in acinar zone 3 (H&E, × 200).
급성 병색소견은 없었으며 활력증후는 혈압 120/80 mm Hg, 맥박수 76회/분, 호흡수 20회/분, 체온 36.6°C였다. 의식은 명료했고, 공막의 황달소견이나 안구돌출은 관찰되지 않았다. 경부에서 갑상선 비대가 보였고 압통은 없었으며, 만져지는 경부 림프절은 없었다. 호흡음과 심음에서 특이소견은 관찰되지 않았고 복부검사에서 우상복부에 간 및 비장비대나 압통은 관찰되지 않았다.
입원 당시 시행한 TSH 0.18 μU/mL, free T4 5.56 ng/dL, T3 376.63 ng/dL, TSI 38.50%, 갑상선 글로불린항체 0.28 U/mL, microsomal antibody 0.94 U/mL로 양성이었고 갑상선스캔에서는 섭취율이 5.0%로 상승되어 있었다. 간 기능검사에서 AST 59 IU/L, ALT 185 U/L, ALP 844 U/L, GGT 424 U/L, 총 빌리루빈 0.7 mg/dL, 알부민 4.3 g/dL, 프로트롬빈 시간 9.2초(international normalized ratio, 0.79초)였다. 간염 표지자검사에서 hepatitis A virus immunoglobulin G (IgG) antibody는 음성을 나타냈고, hepatitis B surface antigen (HBsAg), anti-HBsAg, hepatitis B core antibody (IgG), anti-hepatitis C virus 모두 음성으로 확인되었고, Epstein–Barr virus와 cytomegalovirus polymerase chain reaction도 음성이었다. 면역혈청검사에서 항 평활근 항체, 항간 · 신마이크로좀항체(anti-liver kidney microsomal antibody), 혈중 면역글로불린 G4 모두 음성이었다. 또한 외래에서 시행한 항 미토콘드리아 항체는 음성이었고, 형광 항 핵항체 검사 정량은 1:80으로 항 중심립 항체 양상(anti-centriole antibody pattern)이었다. 단순 흉부촬영소견은 정상이었고, 상복부 또는 하복부 초음파는 간 실질의 에코가 다소 거칠게 관찰되어 만성간질환에 합당한 소견이었으며, 담도 및 췌장 역동성 자기공명영상에서 담도 확장소견은 관찰되지 않았다.
임상적으로 메티마졸에 의한 독성간염이 의심되었으나 다른 원인들을 배제하기 위해 입원 5일째 초음파 유도하 간 생검을 시행하였다. 간 조직검사에서는 급성 담즙정체 간염과 세 정맥 주위 섬유화 소견으로 중심구역 담즙정체와 경도의 큰 소포성 지방변성(10%) 및 약간의 지질 육아종증과 드문 국소적 괴사가 확인되어(Fig. 1D-F) 이를 통해 독성간염을 진단할 수 있었고, 임상적으로 메티마졸에 의한 담즙정체성 독성간염이 의심되었다. 입원 5일째 간 생검 전까지 수액 및 영양 공급을 하며 입원 6일째부터 보존적 치료를 하였다. 환자는 입원 5일 전 AST/ALT 800/844 U/L까지 상승하였으나 입원 시에는 AST/ALT 42/83 U/L로 호전되고, 이후 입원 10일째 AST/ALT 27/36 U/L로 정상화된 것을 확인하였고(Fig. 2), 생검 결과가 나온 입원 12일째에도 상기 치료를 유지하다가 입원 14일째 특이 증상 호소 없이 퇴원했다. 퇴원 후 1일째 외래 추적검사에서 갑상선기능검사 TSH 0.23 μU/mL, free T4 3.09 ng/dL, T3 223.09 ng/dL이고 TSI 37.50%였다. 치료 후 3주 시점에서 방사선요오드(radioactive iodine, I13, 10 mCi) 치료를 하였고, 이후에 갑상선기능검사 추적검사를 하다가 퇴원 4달째부터 갑상선기능저하증에 대해 레보\티록신 나트륨 수화물 0.075 mg을 시작하였고 퇴원 6달째부터는 레보티록신 나트륨수화물 0.1 mg으로 감량하여 유지하며 외래 치료 중이며 정상 간 수치로 잘 유지 중이다.
고 찰
최근 대한갑상선학회와[3] 미국 갑상선학회 및 미국 임상내분비의사회에서[4] 제시한 가이드라인에서는 임신 첫 3개월 이내 혹은 갑상선중독증의 경우를 제외하고는 갑상선기능항진증 치료제로 메티마졸을 사용하도록 권고하고 있다. 이는 PTU 사용과 관련하여 미국에서 중증 간 손상이 보고되면서 미국 식품의약국(Food and Drug Administration)에서 메티마졸을 사용하도록 제시한 것을 받아들였기 때문이다[5]. 갑상선기능항진증 환자는 항 갑상선제 치료 이전에도 고 빌리루빈혈증, AST/ALT의 증가, ALP의 증가 등 경도의 간 기능이상 소견을 보일 수 있다[6]. 또한 PTU와 메티마졸 사용 후 각각 30%, 7%의 환자에서 AST와 ALT의 상승이 관찰되는데[7], 이는 대개 항 갑상선제를 지속 투여하는 중 자연적으로 감소하는 것으로 알려져 있다[4]. PTU는 간 실질세포의 손상을 초래하는 간염형태로 메티마졸은 담즙정체성 황달의 형태로 나타날 수 있는데, 두 약제 모두 중증 간염을 일으키는 경우는 매우 드물다[6].
본 증례는 이전에 급성간염으로 간 생검검사를 통해 심바스타틴 유발 간 손상을 확인한 기왕력이 있는 환자에서 메티마졸 복용 후 AST 800, ALT 844까지 상승되는 급성 중증 간염이 발생한 증례로 한 환자에서 서로 다른 약제에 의해 2회의 중독성 간염이 발생된 매우 드문 예이다. 환자는 메티마졸을 10 mg씩 하루 2회, 20일간 복용한 후 피로감이 발생하였고, 메티마졸 외 원인이 될 만한 약초나 다른 약제의 사용력은 없었으며, 메티마졸을 중단한 시점부터 간 수치는 정상화되었다. 또한 간 조직소견에서 급성 담즙정체성 간염과 세 정맥 주위 섬유화 소견이 확인되었고, 자가면역 항체가 모두 음성으로 자가면역 원인은 배제할 수 있었다.
환자는 국제 자가면역 간염그룹의 진단기준에 따른 자가면역 간염점수는 2점으로 확인되어 자가면역 간질환의 가능성은 매우 떨어지는 것을 확인할 수 있다[8]. 약제유발 간 손상을 확인하기 위한 Councils for International Organizations of Medical Sciences에서 제시한 진단기준 Roussel Uclaf Causality Assessment Method 점수는 8점으로 ‘가능성 높음’에 해당되었다[9]. 따라서 메티마졸에 의한 중증 담즙정체성 간염이 유발된 것으로 판단하였다.
메티마졸에 의한 간 손상의 기전은 아직까지 명확하게 밝혀진 바가 없지만 개체특이반응을 시사하는 소견이 많다[10]. 개체특이반응에 의한 간 손상은 흔하지 않다. 또한 개개인의 감수성이 다르고 한 개인에서도 간 손상의 발현 여부와 시간이 일정치 않고, 간 손상의 발생이 약의 용량과 관계 없이 발생한다[11]. 급성 간 부전의 원인 중 50%가 약인성 간손상에 의해 발생하며, 약인성 간손상의 주된 기전이 개체특이반응에 기인한다[12]. 개체특이반응 약인성 간 손상의 병인은 유전적 소인과 비 유전 소인인 개체 감수성 그리고 환경요인까지 다양하게 관여하는 것으로 생각되고 있다. 비유전 소인으로는 개체 측면으로는 나이, 성별, 기저질환 등이 있고, 물질 특이 위험요소로는 하루 복용량, 대사적 특이성, 약물 상호작용, 약물 간 교차 감수성 등을 고려할 수 있다[11,13].
서로 다른 다양한 약제들이 약제유발 간염 내지는 약제유발 간염의 양상을 갖는 자가면역 간염을 일으킬 수 있고 그 기전은 다양하다. 첫 번째로 약제와 그 대사산물에 의한 면역 매개 기전으로 서로 다른 약제가 면역학적 교차 감수성을 일으킨다. 이러한 약제는 방향족 항 경련제, 앤지오텐신 전환효소 억제제, 비 스테로이드성 항 염증제, 페노타이아진, 삼환계 약물, 살리신산 유도물, 설폰아마이드, 마크로라이드 항생제 등이 있다. 두 번째, 구조적 또는 기능적 유사성으로 인해 발생된다. 이러한 예는 스타틴 등의 지질 저하제와 항 안드로겐 약물이나 종양괴사인자 길항제 등이다. 세 번째, 담즙정체성 간 손상을 유발하는 공통 기전을 갖기 때문이며 이에는 목시플록사신과 아목시실린-클라불라네이트가 해당한다. 이 경우에는 고령이나 약제에 대한 감수성이 있는 주 조직 적합 복합체 자리가 중요하다[14]. 간세포성 약제유발 간 손상과 유전적 요인의 관계가 면역체계에서 중요한 역할을 한다는 최근의 보고가 있으나 이에 대해서는 더 많은 연구가 필요하다[13].
메티마졸이나 프로필티오우라실 등의 티오나마이드 계열은 고령이나 20 mg 이상으로 투여 용량이 많은 경우에 약제유발 간 손상을 잘 일으킨다[15]. 심바스타틴은 알코올 섭취를 하는 경우에 간 손상이 더 잘 발생하고, 혈중 농도에 영향을 미치는 약을 병용 투여하거나 다른 시토크롬 p450 3A4경로(cytochrome P450 3A4) 억제제와 함께 사용하는 등의 약물 상호작용이 있는 조건에서도 약제 유발 간 손상이 더 잘 발생한다[16].
메티마졸과 심바스타틴의 약제 상호반응성도 약제유발 간 손상에 있어 중요한 원인이 되었을 것으로 추정한다. 메티마졸과 심바스타틴은 구조나 기능에서의 유사성을 갖지는 않지만 공통의 대사과정을 공유한다. 심바스타틴이나 메티마졸은 시토크롬 p450경로(cytochrome P450, CYP450)를 거쳐 대사된다. 약물유발 간염의 면역학적 기전은 시토크롬의 역할이 중요한데, 약물이 간에서 CYP450에 의해 대사가 되면 면역반응을 촉진시키기 때문이다. 이 때 대사산물과 간 내 단백질과 결합하여 새로운 항원을 형성하거나 간 내 단백 자체가 표적으로 면역반응이 일어난다. 이처럼 면역학적 감수성 물질이 주 조직 적합 복합체 I 분자와 함께 결합하며, 세포독성 T 림프구에 항원으로 제시되는 과정으로 간세포 손상을 야기한다. 또한 같은 계열의 약물이 갖는 계열효과 역시 교차반응을 유발할 수 있다[17].
심바스타틴 복용 후 발생한 메티마졸 약제유발 간염은 두 약제가 모두 CYP450을 통한 대사과정 때문일 것으로 추측한다[18,19]. 그러나 CYP450을 통한 대사과정을 거치는 약제들이 모두 교차반응성을 갖는 것은 아니며, 이는 면역체계가 외부 항원이 위험신호를 보내는 경우에 한해서만 반응한다는 ‘위험 가설(danger hypothesis)’로 설명할 수 있다[20].
약제유발 간염 발생 시 치료는 원인 약제의 중단, 보존적 치료, 그리고 원인 약제를 재사용하지 않는 것이다. 또한 난치성의 약제유발 간염의 경우 스테로이드가 도움이 될 수 있다[4,21].
본 증례는 고령, 여성, 음주력, 그리고 심바스타틴의 혈중 농도를 높일 수 있는 약제(암로디핀)의 병용 투여를 위험인자로 지니고 있는 환자에서 공통 대사과정을 통한 심바스타틴과 메티마졸에 약물 상호 반응성을 보였던 재발성 약제유발 간염이 발생되었으며, 약제의 중단과 보존적 치료로 완치된 사례이다.
결론적으로 약제유발 간염의 기왕력이 있는 환자에서 유사 대사반응이 가능한 약제를 사용할 경우 재발성 약제유발 간 손상의 발생이 가능하므로 약제의 사용기간 정규적인 간 기능검사의 추적 관찰이 필요할 것으로 생각된다. 또한 위험인자를 지닌 환자에서 전술한 약제를 사용할 때에는 그것이 비록 저 용량일지라도 민감성을 보이므로 약제의 사용에 있어서 주의를 기울여야 할 것이다.
Acknowledgements
This work was supported in part by the Soonchunhyang University Research Fund.