국내 단일기관에서 시행한 13년간의 무수혈 수술 분석
A Single-Center Experience of Transfusion Free Surgical Treatment over 13 Years in Korea
Article information
Trans Abstract
Objective:
Patient’ desire of transfusion free surgery has been increasing due to blood transfusion risks. We analyzed the perioperative parameters and perioperative management of transfusion free surgical treatment in Soonchunhyang University Seoul Hospital.
Methods:
Operation quantity and blood unstoring count from blood bank between 2000 and 2012 were collected from chronological records. Perioperative parameters including preoperative hemoglobin level, postoperative hemoglobin level, and lowest hemoglobin level were collected from medical records. Perioperative blood management such as acute normovolemic hemodilution, intraoperative blood cell salvage, or hematinic agents and complication were assessed.
Results:
A total of 3,088 patients underwent transfusion free surgery at Soonchunhyang University Seoul Hospital between 2000 and 2012. Postoperative hemoglobin level <5.0 g/dL were 33 patients. Four patients expired at postoperative period with serious perioperative complications. Average of expired patient’s hemoglobin was 3.22 g/dL and overall mortality was 0.12%. Operation was increased as years go by. The amount of blood use bank wasn’t increased in general patients with transfusion.
Conclusion:
Careful perioperative blood management for transfusion free surgical treatment was responsible for safety and results in good clinical outcomes. Overall transfusion rate was decreased in spite of increasing operation quantity.
서 론
최근 미국에서 수혈은 Blood Shield Law에 의해 ‘unavoidably, unsafe, and inherently dangerous’로 알려져 매년 줄고 있는 추세이며, 이를 대체할 많은 방법이 논의되고 있다[1]. Food and Drug Administration 산하 Center for Biologics Evaluation and Research의 2011-2012년 보고에 따르면 미국에서도 해마다 동종혈액의 수혈이 줄고 있으며 이에 의한 사망률도 줄고 있다고 하였다. 현재 미국에서는 연 24,000,000단위의 혈액이 사용되고 있으며, 한국에서는 대한적십자사의 혈액사업통계 연보에 의하면 2012년 한 해 동안 헌혈을 한 인원은 2,542,495명이며, 4,399,056단위의 혈액이 공급되고 있다고 보고되었다.
동종혈액의 수혈은 혈액을 통한 전염병의 전파, 알레르기성과 용혈성 수혈반응, transfusion related acute lung injury (TRALI), 그리고 면역억제 같은 부작용을 증가시킨다[2-4]. 그 외에도 immunomodulation과 알려지지 않은 위험(Creutzfeldt-Jakob disease, West Nile virus 등)도 포함하고 있다. 이로 인해 재원기간이 연장될 뿐 아니라 다발성장기기능부전증후군과 사망률을 증가시킨다고 알려져 있다[5-7].
순천향대학교 서울병원은 1999년부터 무수혈 수술을 시작하였고, 2000년 3월 무수혈센터를 개설하여 2013년 현재까지 다수의 무수혈 수술을 시행해 왔으며 이를 위한 다양한 대체방법을 도입하여 수혈에 따른 부작용과 불필요한 혈액의 사용을 줄이려고 노력하고 있다. 이에 저자는 순천향대학교 서울병원에서 시행된 무수혈수술에 대한 자료와 혈액출고량 등을 후향적으로 분석하여 현재까지의 무수혈 수술의 추세와 이를 대체할 수 있는 다양한 수혈대체방법들의 사용 추세를 알아보기 위해 본 연구를 계획하였다.
대상 및 방법
2000년 1월부터 2012년 12월까지 순천향대학교 서울병원에서 실시한 총 수술 시행 건수와 성분별 혈액 출고량을 연대순으로 조사하였다. 또한 연도별 무수혈 수술 시행 건수도 분석하였고, 무수혈 수술을 시행 받은 환자의 수술 전 혈색소 수치와 수술 후 혈색소 수치, 재원기간 중 가장 낮은 혈색소 수치와 사망률에 대해 조사하였다. 또한 무수혈수술 시 사용된 다양한 대체방법 즉, hematinic agents인 적혈구생성인자(erythropoiesis-stimulating agents), 철분(intravenous iron)의 사용, antifibrinolytic agent (aprotinin)의 사용과 acute normovolemic hemodilution (ANH), 수술 중 혈액회수법(cell saver) 같은 수술 중 수혈대체요법의 사용에 대해서도 조사하였다. 또한 무수혈 수술을 받은 환자의 사망률을 조사하였다.
결 과
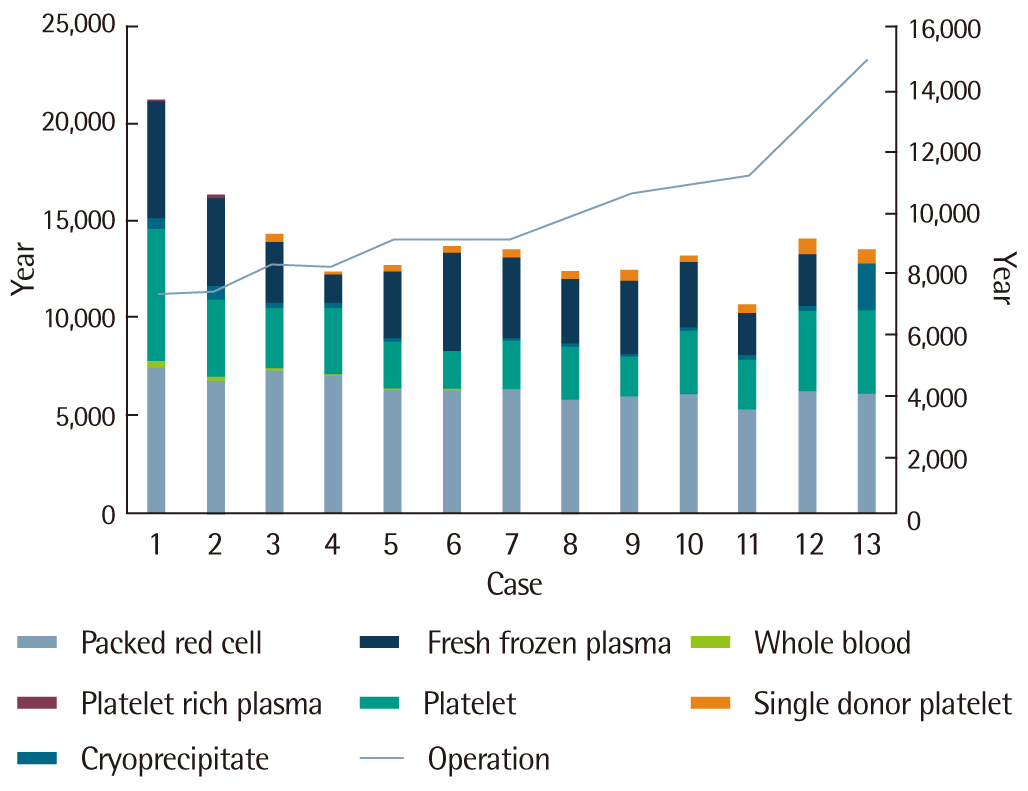
2000년부터 2012년까지 총 127,390건의 수술이 시행되었고, 총 168,955단위의 혈액이 순천향대학교 서울병원 혈액은행에서 출고되었다. 이 기간의 수술 건수는 점차 증가하는 추세를 보였으나 혈액 출고율은 수술 건수에 비해 점차 감소하는 추세를 보였다(Fig. 1).
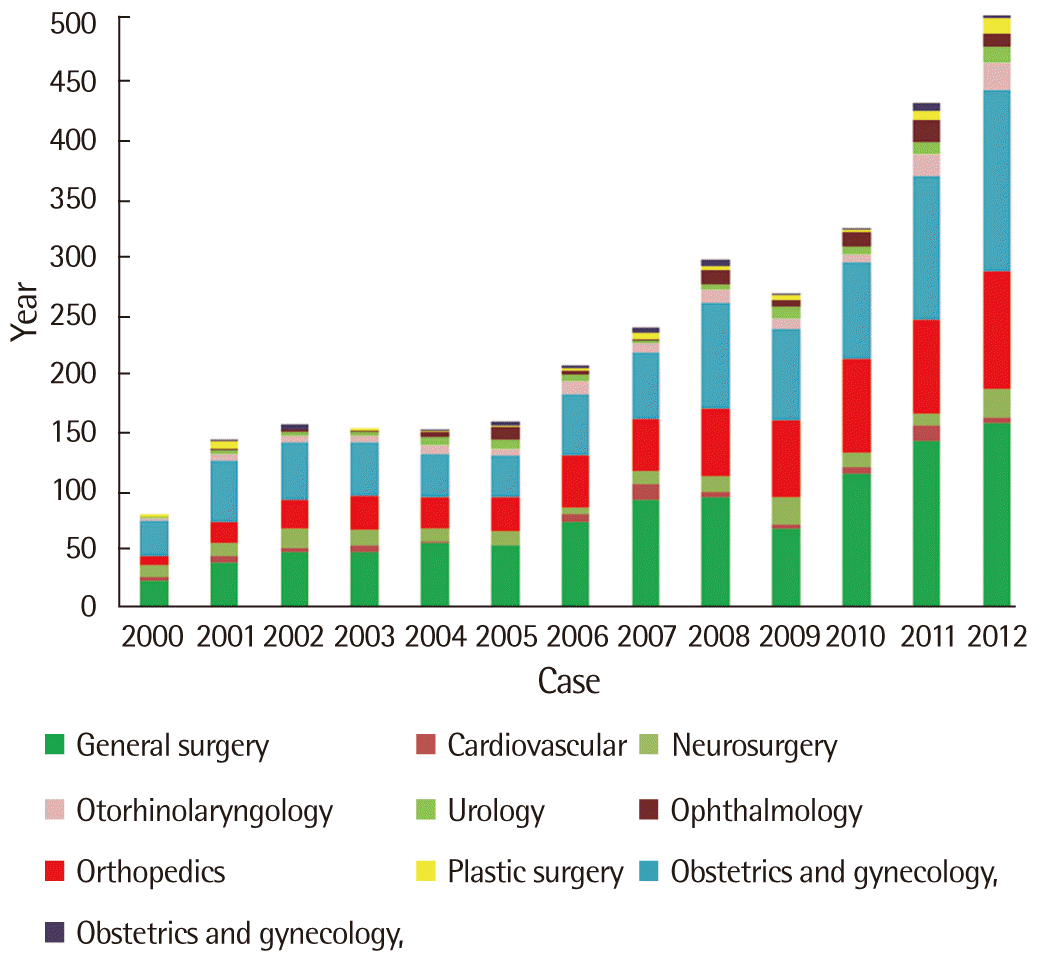
무수혈 수술을 위한 주술기 수혈대체요법(iron, erythropoietin, ANH, cell saver, aprotinin) 사용도 점차 증가하고 있는 추세를 보였다(Fig. 2). 전체 127,390건의 수술에서 무수혈 수술은 3,088건이었으며, 각 과별로 무수혈 수술을 시행 받은 건수는 다음과 같다(Fig. 3): 일반외과 992건(32.1%); 산부인과 881건(28.5%); 정형외과 601건(19.5%); 신경외과 174건(5.6%); 비뇨기과 76건(2.5%); 흉부외과 69건(2.2%); 이비인후과 121건(3.9%); 성형외과 56건(1.8%); 안과 82건(2.7%); 기타(치과, 소화기내과) 36건(1.2%).

Perioperative blood management such as acute normovolemic hemodilution, intraoperative blood cell salvage, or hematinic agents were assessed.
Three thousand and eighty-eight patients underwent transfusion free surgery at Soonchunhyang University Seoul Hospital between 2000 and 2012.
무수혈 수술 후 혈색소 수치가 5.0 g/dL 미만인 환자는 33명이었고, 이 중 4명의 환자가 심각한 수술 관련 합병증으로 사망하였다. 혈색소 수치가 5 g/dL인 환자에서의 사망률은 12%로 Carson 등[8]의 보고에 비하여 낮았고, 사망한 환자의 평균 혈색소 수치는 3.22 g/dL이었으며, 전체 3,088명의 무수혈 환자에서의 사망률은 0.12%였다.
고 찰
동종혈액의 수혈은 전염병의 전파, 알레르기성과 용혈성 수혈반응, 그리고 면역억제 같은 부작용을 증가시키며[2-4], 대장암 환자에서 수술 전후 시행한 수혈이 암의 재발, 생존율에 영향을 미친다는 보고가 있은 후로, 여러 암에서 수혈의 위험성이 점차 광범위하게 인식되고 있다[9]. 또한 수혈 후 발생한 호흡부전으로 정의되는 TRALI는 임상증상이 다양하고, 특별한 진단기준이나 임상지표가 없어 유병률이 0.08%에서 15%로 다양하게 보고되고 있으며[10-12], 수혈과 관련된 주된 사망원인으로 알려져 있다[13-16]. 이렇게 수술 전후의 수혈은 재원기간을 연장시키고, 사망률을 증가시킨다고 알려져 최근에는 종교적인 이유뿐 아니라 수혈의 부작용에 대한 인식으로 수혈을 거부하고 무수혈 수술을 선호하는 환자들이 늘어나고 있는 추세이다[6].
순천향대학교 서울병원에서도 2000년에 무수혈센터가 개설된 후 13년 동안 꾸준히 무수혈 수술이 증가하고 있는 추세를 보였다. 그뿐 아니라 그 기간 총 수술 건수는 꾸준히 증가함에도 불구하고 순천향대학교 서울병원 혈액은행에서의 혈액 출고량은 수술 건수에 비해 오히려 감소하는 추세를 보이는 것으로 나타났다. 또한 같은 시기에 다양한 주술기 수혈대체요법은 매년 증가하고 있는 양상 을 보였다. 수혈 대체요법에는 hematinic agents인 적혈구생성인자 (erythropoiesis-stimulating agents), 철분(intravenous iron)을 사용하는 방법, 지혈제인 antifibrinolytic agent (aprotinin)을 사용하는 방법과 수술 중에 시행하는 ANH, 수술 중 혈액회수법(cell saver) 등이 있다. 순천향대학교 서울병원에서 사용된 주술기 수혈대체요법을 자세히 살펴보면 주술기 iron제제의 사용은 전반적으로 매년 증가하는 추세를 보였고, erythropoietin의 사용 역시 증가하는 양상을 보였다. 그러나 2007년 기점으로 철분제제에 비해 erythropoietin의 사용량이 크게 늘지 않는 양상을 보이고 있는데 이는 chronic kidney disease 환자를 대상으로 한 대규모 연구에서 erythropoietin을 사용해서 과도하게 빈혈을 교정하는 것이 사망률과 이환율을 증가시킨다는 결과에 의한 영향이라고 생각된다 [17,18]. 또한 ANH, cell saver의 사용도 꾸준히 증가하는 양상을 보이고 있다. 지혈제인 aprotinin의 경우에는 사용량이 꾸준히 증가하다 2008년 이후 사용되지 않았는데 이는 이 시기에 발표된 대규모 연구에서 타 지혈제에 비해 aprotinin이 사망률의 증가와 수술 후 creatinine의 증가에 연관이 있다는 결과[19]에 의한 것으로 그 이후 다른 지혈제의 사용은 보고되지 않았다.
무수혈 수술 환자의 사망률 연구에서 Carson 등[8]은 여호와의 증인 환자에서 혈색소 수치가 8 g/dL 미만인 경우 30일 사망률이 16%라고 보고했고, 8 g/dL에서 1 g/dL씩 떨어질 때 사망률이 2.5배씩 증가한다고 하였다. 또한 혈색소 수치가 4.1-5 g/dL일 때 사망률이 34.4%에 이른다고 보고하였다. 하지만 순천향대학교 서울병원에서 무수혈 수술을 시행한 환자들의 재원기간 내 사망률은 0.12%이었고, 고위험군으로 분류된 수술 후 혈색소 수치 5 g/dL 미만의 환자들에서의 사망률도 12%로 비교적 낮게 나타났다. 이는 순천향대학교 서울병원에서 수술 시 출혈을 감소시키고, 수혈을 줄일 수 있다고 알려진 iron, erythropoietin 등 조혈을 위한 약물의 사용, ANH, 수술 중 혈액 회수법인 cell saver의 사용과 다양한 지혈제의 사용 등의 perioperative blood management를 적극적으로 시행한 결과로 보여진다[20-22]. 이런 주술기 수혈대체요법의 적극적인 사용과 이로 인한 혈액 사용량 감소는 수혈로 인한 수혈부작용 또한 크게 감소시켰을 것이라고 생각되나 본 논문에서는 수혈부작용의 빈도를 조사할 수 없어서 확실한 연관은 찾지 못하였다.
순천향대학교 서울병원에서는 주의 깊은 perioperative blood management로 수혈의 빈도를 감소시키면서 안전하게 무수혈 수술을 시행하고 있고, 이는 좋은 예후를 나타내고 있는 것으로 보인다. 본 연구의 제한점은 같은 기간의 혈액 관련 부작용 빈도변화를 조사하지 못해 혈액 사용과 부작용 감소의 연관성을 찾지 못한 점과 유병률과 사망률이 낮은 수술과 높은 수술 간의 차이를 분석하지 않은 점이다. 또한 이후에는 무수혈 수술을 시행하고 있는 다른 여러 병원과의 비교연구도 필요할 것으로 보인다.