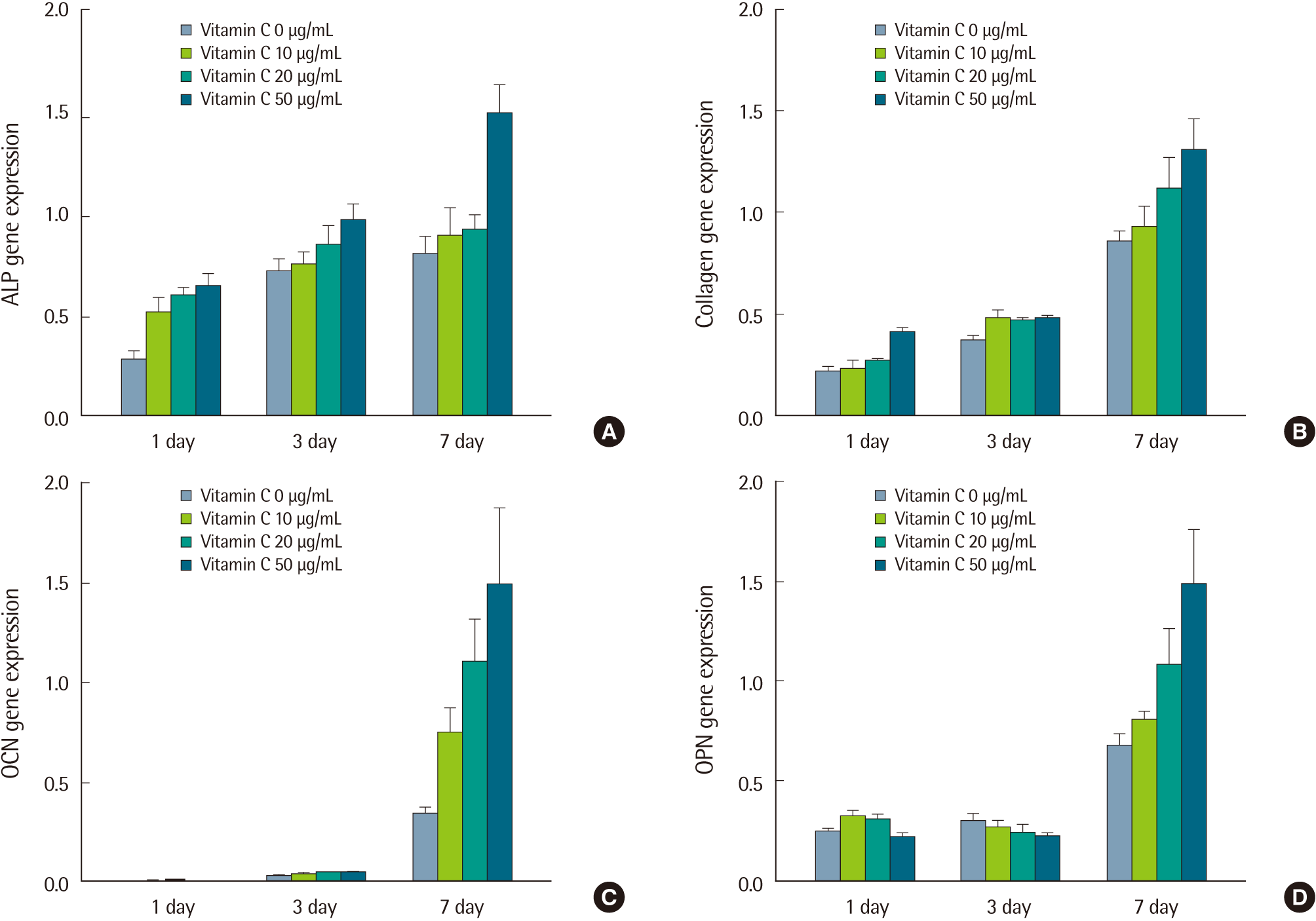서 론
최근 각종 산업재해 및 교통사고가 증가하고 고령화 사회로 접어들면서 골다공증 및 그에 따른 골절 등에 의한 근골격계 질환이 증가하고 있다[1]. 이와 같은 골질환 등의 예방과 치료를 위하여 골재생 능력유도를 위한 다양한 형태의 뼈이식제와 조골세포의 활성향상 및 파골세포의 활성을 저하시키기 위한 새로운 형태의 관련 질환 치료제들이 개발되고 있다. 또한 골종양, 골결손이 심한 부위를 채울 수 있는 신생골을 능동적으로 유도하기 위하여 줄기세포와 조골세포를 이용하여 다양한 연구가 시도되고 있다. 골의 형성과정에 조골세포의 분화는 유전형질의 발현에 의해 조절되며, 배양방법에 따라 고유의 특성을 가지고 있다. 즉, 증식과 분화, 석회화 과정을 거치며 type I collagen (Col 1), alkaline phosphatase (ALP), osteopontin (OPN), osteocalcin (OCN) 등의 골 관련 형질표현 유전자가 발현된다[2]. 이러한 조골세포에서 분화를 유도하는 데 이용되는 물질로는 ascorbic acid, β-glycerophosphate, dexamethasone 등이 자주 사용되고 있다[3]. 일반적으로 vitamin C로 알려진 ascorbic acid는 강력한 항산화제 기능과 함께 여러 가지 중요한 펩티드 호르몬, 신경전달물질, 카르니틴의 합성에서 중요한 역할을 하고 있다고 알려져 있다[4]. 또한 ascorbic acid는 뼈, 치아, 근육, 관다발 조직, 인대 등을 형성하는 세포 간 결합물질인 collagen을 합성하는 데 꼭 필요한 물질로 알려져 있다[5-8]. 본 연구의 목적은 골생성과 관련된 조골세포의 전구세포인 MC3T3-E1 세포주를 이용하여 조골세포의 분화에 영향을 미치는 물질로 알려진 ascorbic acid 단독의 효과를 알아보기 위해 실시하였다.
대상 및 방법
1. 세포배양
본 실험에 사용된 MC3T3-E1 세포는 10% fetal bovine serum와 1% penicillin-streptomycin을 첨가한 alpha-minimum essential medium (α-MEM, Gibco BRL; Grand Island, NY, USA) 배지를 사용하여 37°C, 5% CO2 세포배양기에서 배양하였다. 배양접시에 특정수의 세포를 분주하고, 24시간 후 다양한 농도의 ascorbic acid를 함유한 α-MEM 배지로 교체하였다. 배지는 3일 간격으로 교체하였으며, 이때 각 농도의 ascorbic acid를 함유한 배지로 교환하였다.
2. Ascorbic acid 처리
Ascorbic acid (Sigma, St. Louis, MO, USA)는 멸균 증류수에 50 μg/mL 농도의 고정용액(stock solution)을 만들어, 각 0, 10, 20, 50 μg/mL의 농도로 희석하여 세포배양액에 첨가하였다.
3. MTT 분석
각각의 농도로 처리한 ascorbic acid의 세포독성 유무를 알아보기 위하여 MC3T3-E1 세포주를 48 well plate의 각 well당 5×104개의 세포가 들어가도록 분주한 후 세포들이 부착될 수 있도록 1일간 37°C, 5% CO2의 세포배양기에 배양한 후 배지를 교환하고, 실험군에는 ascorbic acid를 각 농도별로 첨가하여 1, 3일 동안 배양하였다. 각각의 시간이 경과된 후 다양한 농도의 ascorbic acid로 배양된 세포를 5 mg/mL의 농도의 MTT (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide; Sigma) 50 μL씩을 well에 처리하여, 4시간 동안 37°C 배양기에서 배양하였다. 보라색 결정이 생성되면 배지를 제거해주고 250 μL의 DMSO (dimethyl sulfoxide)를 첨가하여 형성된 formazan 결정을 용해시킨 후 용해된 용액을 96-well plate에 100 μL씩 분주하고 enzyme-linked immunosorbent assay (ELISA) 분석기(Tecan Infinite F50; Tecan, Mannedorf, Switzerland)로 595 nm에서 흡광도를 측정하여 세포생존율을 확인하였다. 각 실험군마다 3번 반복하였으며 한 번의 실험에서 독립적으로 2번의 실험을 실시하였다.
4. Live-dead cell 형광염색
MC3T3-E1 세포를 현미경 관찰용 배양접시(coverslip bottom dish)에 1×105의 세포 수로 분주하였다. 24시간 뒤에 각 농도의 ascorbic acid가 포함된 배지로 교체해주고, 1, 3, 7일 동안 배양하여 상용화된 kit (live/dead viability cytotoxicity kit; Invitrogen, Carlsbad, CA, USA)를 사용하여 제조사의 사용법에 따라 세포를 염색한 뒤 공초점 현미경(Olympus fluoview FV10i; Olympus, Tokyo, Japan)으로 세포를 관찰하였다. 이때 활성세포는 녹색으로 관찰되고, 사멸세포는 붉은색으로 관찰된다.
5. F-actin 형광염색
각 농도의 ascorbic acid가 포함된 배지로 1, 7, 14일 동안 배양한 뒤 세포의 골격을 관찰하기 위하여 F-actin 형광염색을 시행하였다. 배지를 제거한 뒤, 4% paraformaldehyde로 15분간 세포를 고정하였다. 고정된 세포는 멸균 증류수로 3번 반복하여 세척하고 0.2% Triton X-100 (Sigma-Aldrich, St. Louis, MO, USA)을 이용하여 10분간 세포막을 용해시킨 뒤 2.5% bovine serum albumin 용액으로 1시간 처리하였다. 처리 후 FITC-phalloidin (Sigma-Aldrich)을 넣고 상온에서 4시간 동안 빛을 차단하여 보관한 뒤 멸균 증류수로 3회 반복 세척하고 Hoechst 33342 (Sigma-Aldrich)에 10분간 염색하여 공초점 현미경(Olympus fluoview FV10i; Olympus)으로 관찰하였다.
6. Total RNA 분리 및 real-time polymerase chain reaction
특정 유전자의 발현을 알아보고자 6 well plate에 1×105개의 세포를 분주하여 1일, 7일, 14일 동안 배양하였으며 배양된 세포에서 배지를 제거하고 Ribo EX Reagent (Hybrid-R; GeneAll, Seoul, Korea)를 사용하여 시료를 균질화한 뒤 제조사의 지침에 따라 total RNA를 추출하였다. cDNA 제작을 위해 reverse transcriptase와 reaction mix가 포함된 cDNA synthesis kit (iScript cDNA synthesis kit; Bio-Rad, Hercules, CA, USA)를 이용하여 1 μg의 RNA 시료와 혼합한 뒤 thermal cycler (Applied Biosystem, Foster City, CA, USA)에 넣고 25°C에서 5분, 42°C에서 30분, 85°C에서 5분간 반응시켜 cDNA를 합성하였다. 이렇게 얻은 cDNA 1 μL와 10 Pmole의 primer를 SYBR Green mixture (iTaq Universal SYBR Green Su-permix; Bio-Rad)와 혼합하여 Thermal cycler (Mini Opticon; Bio-Rad)를 이용해 real-time polymerase chain reaction (PCR)을 수행하였으며 각 primer의 염기서열과 실험조건은 아래에 표기하였다(Tables 1, 2). 정량적 결과분석을 위하여 GAPDH (glyceraldehyde 3-phosphate dehydrogenase)의 발현 정도로 표준화하였으며, 한번의 실험에서 각 실험군마다 3번 반복하였으며 독립적으로 2번의 실험을 실시하였다.
결 과
1. MTT 분석
다양한 농도의 ascorbic acid가 첨가된 배지에서 1, 3일 동안 배양한 뒤, 세포 생존도를 측정하였다. 그 결과 배양 첫째 날에는 전반적으로 ascorbic acid를 처리한 그룹과 처리하지 않은 시료의 세포생식에 크게 차이가 없는 것으로 관찰되었으나 배양 3일의 결과에서는 ascorbic acid 처리군과 대조군의 차이가 명확하게 관찰되었다(Fig. 1). 특히 ascorbic acid 50 μg/mL에서 유의성 있는 세포증가를 나타내었다. 따라서 상기 처리시간과 농도에서 ascorbic acid에 의한 세포의 증식이 잘 이루어지는 것을 확인하였다.
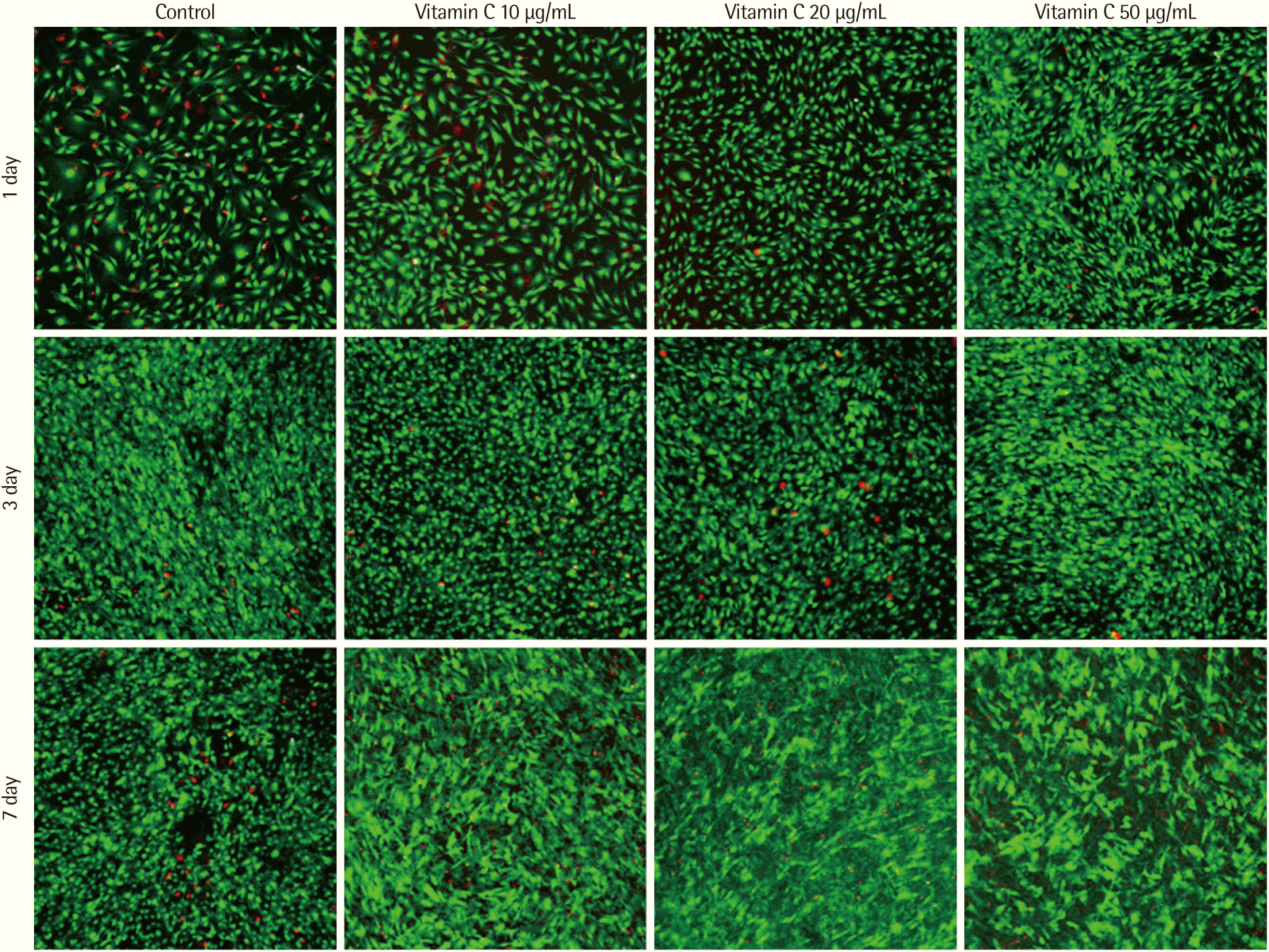
2. Live-dead cell 형광염색
Live-dead cell 형광염색법으로 살아있는 세포와 죽은 세포를 관찰할 수 있는데, 이때 살아있는 세포는 녹색으로 죽은 세포는 빨간색으로 관찰된다. 그림에서 보이듯이 빨간색으로 관찰되는 부분이 존재하지만 대부분의 세포가 살아있는 세포로 관찰되었다(Fig. 2). 이러한 결과로 ascorbic acid를 처리한 후에도 세포에 대한 독성이 유발되지 않은 것을 확인할 수 있었다.
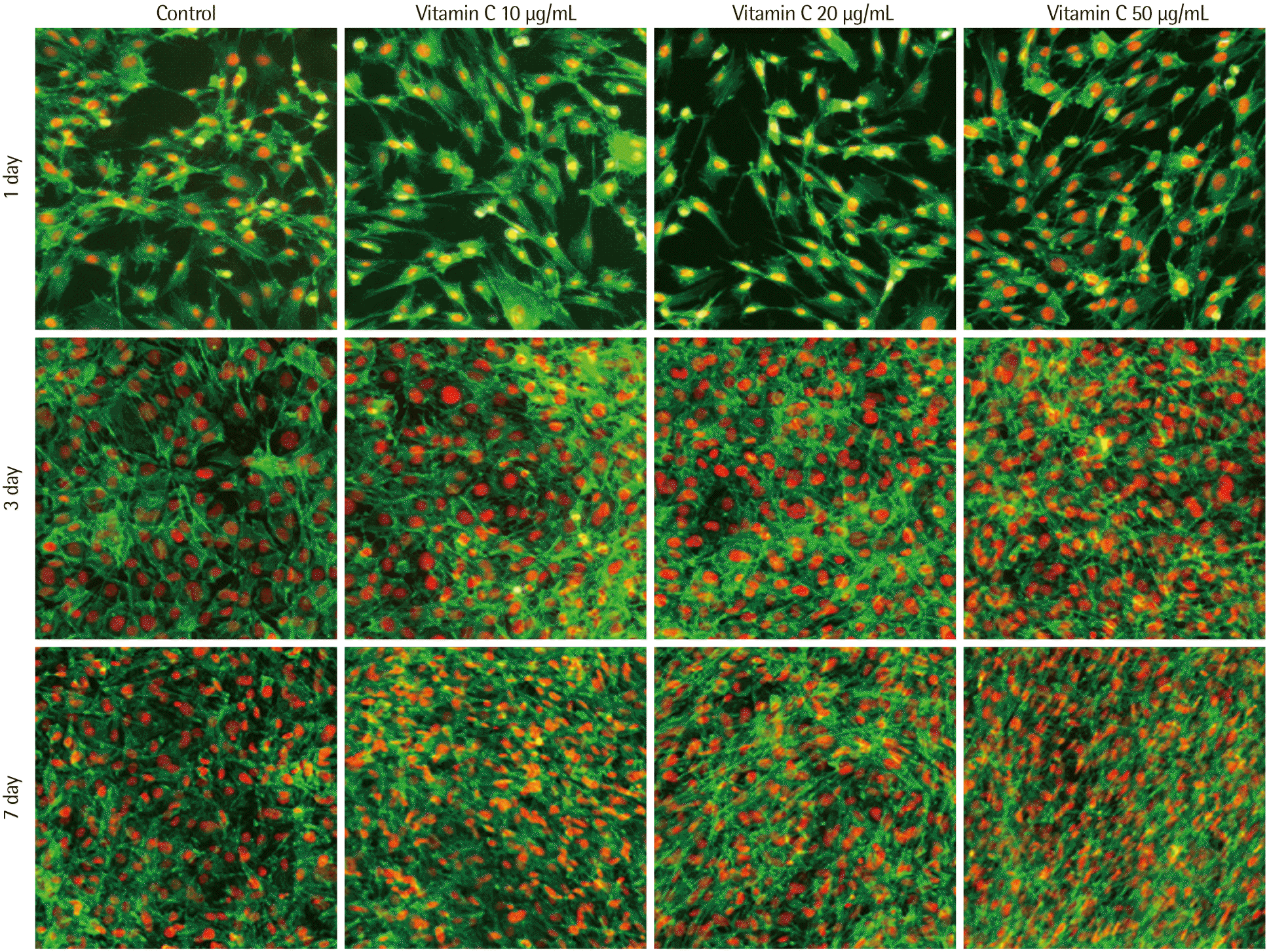
3. F-actin 형광염색
공초점 현미경으로 세포를 관찰하였으며 세포골격을 이루는 Factin은 phalloidin-FITC로, 핵을 이루는 부분은 Hoechst 33342로 염색을 하여 관찰하였다. 이때 F-actin은 녹색으로 핵은 붉은색으로 관찰되었다. 배양된 모든 그룹의 세포들의 시간이 경과함에 따라 증식과 부착이 안정되게 이루어지는 것을 볼 수 있었으며(Fig. 3), 전체적으로 7일 그룹에서 가장 많은 세포의 증식이 이루어짐을 알수 있다. 7일이 경과한 후 ascorbic acid를 처리한 그룹에서 대조군과 다르게 F-actin과 핵이 일정한 방향성을 나타냈으며, 이는 세포를 분화시켰을 때 나타나는 세포의 양상과 매우 흡사하게 보였다.
4. Real-time polymerase chain reaction
각 농도의 ascorbic acid를 처리하여 14일까지 배양 후, ALP, Col 1, OCN, OPN의 mRNA 발현을 조사하였으며 mRNA의 발현 정도는 real-time reverse transcription-PCR의 threshold cycle을 통해 추정하였다. ALP는 시간이 경과함에 따라 그룹 간의 발현 증가량이 비슷하게 유지되었으나 50 μg/mL의 ascorbic acid를 처리한 후 14일째에 다른 그룹보다 ALP의 발현이 증가하는 것을 확인하였다(Fig. 4A). Col 1은 1일과 7일에는 처리한 ascorbic acid와 시간에 상관없이 서로 비슷한 발현 양상을 보였으나 14일이 경과한 그룹에서는 전반적으로 Col 1의 발현이 증가하였다(Fig. 4B). OCN은 1일과 7일 그룹에서는 발현이 굉장히 약했으나 14일이 경과하고 OCN의 발현이 모든 농도의 그룹에서 현저히 증가하였으며 ascorbic acid의 농도가 높아질수록 OCN의 발현이 더욱 증가하는 것을 확인할 수 있었다(Fig. 4C). OPN 역시 OCN과 비슷한 양상을 보이며 1일과 7일째 그룹에서는 아주 약한 발현을 보였으나 14일이 경과한 후 OPN의 발현 또한 처리한 ascorbic acid의 농도가 높아질수록 증가하는 것을 확인하였다(Fig. 4D).
고 찰
일반적인 전조골세포를 조골세포로 분화시키는 데 있어 ascorbic acid, β-glycerophosphate, dexamethasone 등이 사용된다[9]. 본 연구에서는 ascorbic acid가 단독 처리된 전조골세포의 증식과 세포독성 및 분화 관련 유전자의 mRNA 수준을 평가하여 ascorbic acid의 영향을 알아보고자 했다. 세포의 증식을 평가하기 위해 MTT 시험을 실행했으며 그 결과는 Fig. 1과 같이 3일에서 대조군과 실험군의 뚜렷한 세포증식의 차이를 관찰할 수 있었다. 이 결과로 보아 ascorbic acid는 세포증식에 영향을 미칠 수 있는 가능인자로 평가 할 수 있다. 하지만 실험기간과 농도를 장기화 및 다양화를 통하여 좀 더 명확한 결과를 얻을 필요성이 있다. 실제 조골세포 및 줄기세포의 골세포 분화에서 ascorbic acid의 농도를 결정하는 데 큰 도움이 될 수 있다. 세포 핵과 F-actin 형광염색 그리고 live-dead cell 형광염색을 통한 공초점 현미경 관찰에서 세포의 골격 및 형태를 관찰하고 세포독성을 평가하였다. 우선 실험기간 동안 ascorbic acid를 처리한 MC3T3-E1의 실험군에서 대조군과 비교하여 세포독성의 영향은 거의 관찰할 수 없었고 F-actin 형광염색에서 또한 실험군에서 상대적으로 대조군보다 MC3T3-E1 세포의 모양이 양쪽으로 뻗어 있으며 일정한 방향성을 갖는 것이 관찰되었다. 이는 마치 ascorbic acid, β-glycerophosphate, dexamethasone를 모두 처리하여 분화시켰을 때의 MC3T3-E1 세포 모양과 흡사하다. 이러한 결과로 ascorbic acid는 전조골세포의 모양을 섬유아세포(fibroblast)처럼 보이게 하는데 영향을 줄 뿐만 아니라 처리된 농도와 기간에서는 전혀 세포독성을 보이지 않는 것으로 평가되었다. 물론 세포 증식 증가에 따른 세포 농도의 증가로 인한 현상으로 세포의 모양이 변화될 수 있는 가능성은 있으나 MC3T3-E1 세포의 조골세포 분화에 따른 세포형태 변화에 ascorbic acid가 도움을 줄 수 있는 가능성 또한 상당히 있는 것으로 판단된다[10-13]. 전조골세포의 골세포 분화에 영향을 주는 ascorbic acid 처리 후 분화와 관련된 유전자의 변화를 관찰하여 ascorbic acid가 조절할 수 있는 분화 관련 유전자의 특성에 대해 평가하였다. ALP는 분화의 정도를 나타낼 수 있는 지표 유전자로 ascorbic acid 처리효과를 거의 볼 수 없는 것으로 관찰되었다. 다만 14일째 배양의 50 μg/mL 처리에서 상대적으로 약 1.5배의 증가를 보이는 것으로 나타났다. 이는 ascorbic acid 의 농도가 10-20 μg/mL과 같이 낮은 농도에서는 ALP를 증가시켜 분화하는 세포에 크게 도움을 주지 못하는 것으로 평가된다. 분화과정의 여러 부분에 관련된 collagen의 발현은 처리 농도 증가에 따라 collagen 발현 경향도 증가되는 것으로 나타났다. 배양 1일과 7일째에는 collagen 유전자 발현 증가 영향이 거의 없었지만 배양 14일째 2배 이상의 collagen 유전자 발현을 관찰하였다. 이는 조골세포 초기의 collagen 유전자 발현과 상이한 결과로서 β-glycerophosphate와 dexamethasone 존재하의 조건과 분리하여 고려해야 할 것으로 판단된다. OCN과 OPN은 일반적으로 분화 후기에 발현되는 유전자들로 이번 PCR 실험에서도 거의 같은 양상을 보였다. 초기 배양 7일까지는 두 유전자가 거의 발현되지 않는 것으로 나타났으나 14일 배양에서는 대조군에 비해 ascorbic acid를 첨가한 실험군에서 유의한 증가를 보였다. 이와 같은 결과는 ascorbic acid가 상대적으로 분화 초기보다는 분화 후기에 관련 유전자에 보다 많은 영향을 주는 것으로 판단된다[14,15]. 하지만 앞에서도 잠시 언급했듯이 본 연구의 실험조건은 최적화된 분화 조건에서 ascorbic acid의 유무와는 또 다른 조건이다[16-19]. Ascorbic acid가 단독 처리된 이러한 조건에 대한 결과는 보다 기본적이고 기초적인 연구에 도움이 될 수 있을 것이라 판단된다[20]. 따라서 본 실험에서는 MC3T3-E1세포를 대상으로 ascorbic acid를 단독 처리하여 관찰한 결과 세포증식과 세포의 형태에 영향을 줄 수 있고 세포독성에는 거의 관계가 되지 않는 것으로 관찰되었으며 조골세포 분화에 관계된 ALP, collagen, OCN, 그리고 OPN 등의 유전자를 배양시간에 따라 조절할 수 있는 것으로 관찰하였다.